解决方案 | 新冠疫苗包装材料金属迁移知多少
药品中的残留溶剂系指在原料药或辅料的生产中,以及在制剂制备过程中使用的,但在工艺过程中未能完全去除的有机溶剂。在原料药合成工艺中,选择适当的溶剂可提高产量或决定药物的性质,如晶型、纯度、溶解速率等。因此有机溶剂在药物合成反应中是必不可少和非常关键的物质。下图为阿莫西林合成路线,使用了三乙胺((C2H5)3N)。

阿莫西林合成路线图
当药品所含的残留溶剂水平高于安全值时,就会对人体或环境产生危害,应尽可能除去所有残留溶剂,以符合制剂质量标准、生产质量管理规范(GMP)或其他质量要求。
《中国药典》2020年版《0861残留溶剂测定法》通则主要根据ICH《IMPURITIES: GUIDELINE FOR RESIDUAL SOLVENTS Q3C(R7)》制定,药品中残留溶剂根据安全性主要分为4类,共涉及70种溶剂。
● 异丙基苯从第三类溶剂(限度0.5%)修改为第二类溶剂(限度为0.007%)
● 甲基异丁基酮从第三类溶剂(限度0.5%)修改为第二类溶剂(限度为0.45%)
● 增加三乙胺(齐多夫定、拉米夫定等需要检测)为第三类溶剂,限度为0.5%
● “四氢噻吩”修改为“环丁砜”,限度仍为0.016%
2020年4月29日国家药品监督管理局药品审评中心(CDE)在官网上发布了“关于公开征求ICH《Q3C(R8):杂质:残留溶剂的指导原则》指导原则草案意见的通知”。本次征求稿增加了3种溶剂限量要求,具体变化如下:

2020版药典二部化药共有249个品种标准在【检查】部分收载“残留溶剂”项目,相比2015版药典,42个品种新增订【残留溶剂】项目。经统计汇总,2020版药典化药二部234个品种标准【残留溶剂】项目说明了具体的检测方法(需要检测溶剂种类、对照、供试品溶液制备、色谱条件、系统适用性要求),“二甲磺酸阿米三星”、“乌苯美司”、“双环醇”等15个品种标准【残留溶剂】并没有说明具体检测方法,仅提到引用0861通则,其中12个是2020版药典新增品种。
药品残留溶剂 / 检测解决方案

GCMS-QP2020 NX
气相色谱质谱联用仪
● 集成高灵敏度和低实验成本
● 高效运行,减少停止时间
● LabSolutions Insight让多数据分析更高效
● 全惰性化GC/MS流路
Nexis GC-2030
气相色谱仪
● 全新智能交互界面为分析人员贴心设计
● 创新ClickTek技术全面提升用户分析体验
● 出类拔萃的超高灵敏度及重现性


HS-20
顶空进样器
● 卓越的性能
● 良好的重复性
● 友好的界面设计
● 灵活的拓展性
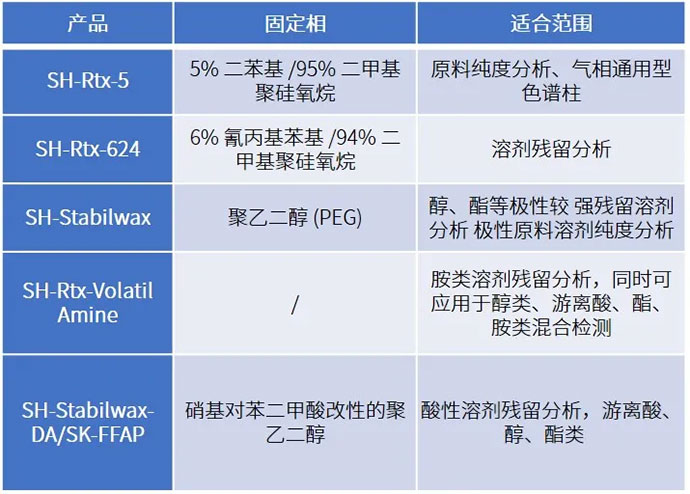
药品残留溶剂 / 检测应用实例
01 GC结合HS-20顶空进样器测定药品中18种溶剂残留

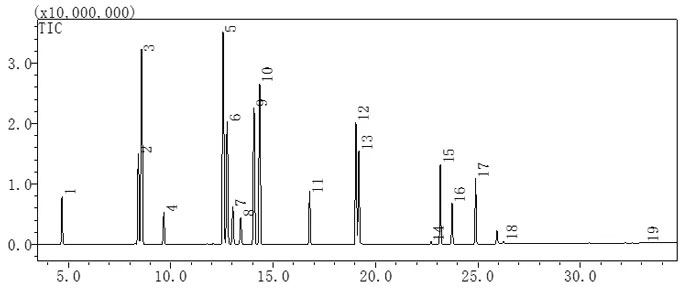
18种溶剂标准溶液色谱图
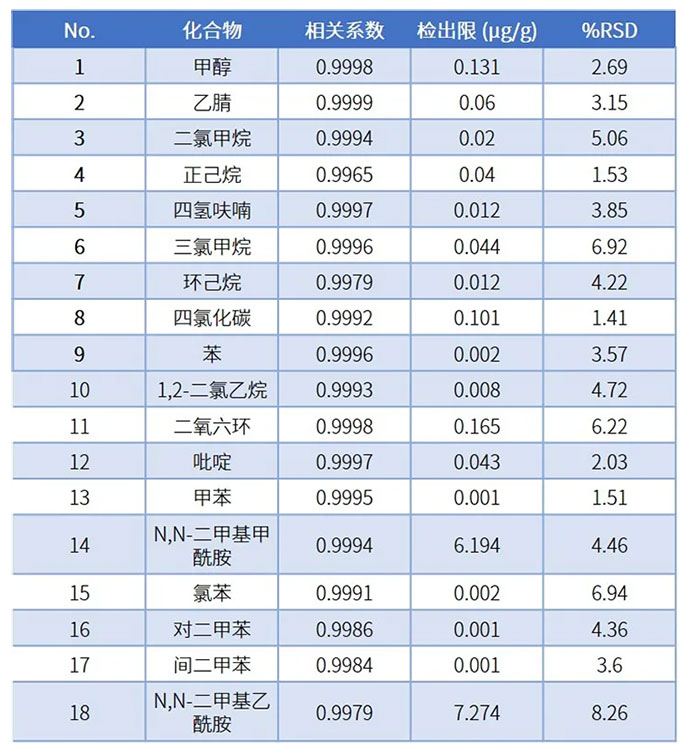
使用纯水配制溶剂残留混合标准系列溶液,每1mL含各种溶剂浓度分别为0.1、0.5、1.0、2.0、5.0µg,制作标准曲线,线性良好。根据0.1μg/mL标准溶液数据,计算方法检出限(3倍噪声计算)。各组分检出限见下表,检出限均达到通则限度1/30以下,且峰面积重现性良好(顶空进样精密度RSD应达到10.0%以内)。
将溶剂残留混标溶液添加到市售小儿氨酚烷胺颗粒中,按照样品前处理方法制备,样品中加标浓度分别为0.5 μg,样品加标回收率为87.89 ~117.46%。
19种溶剂混标溶液总离子流色谱图
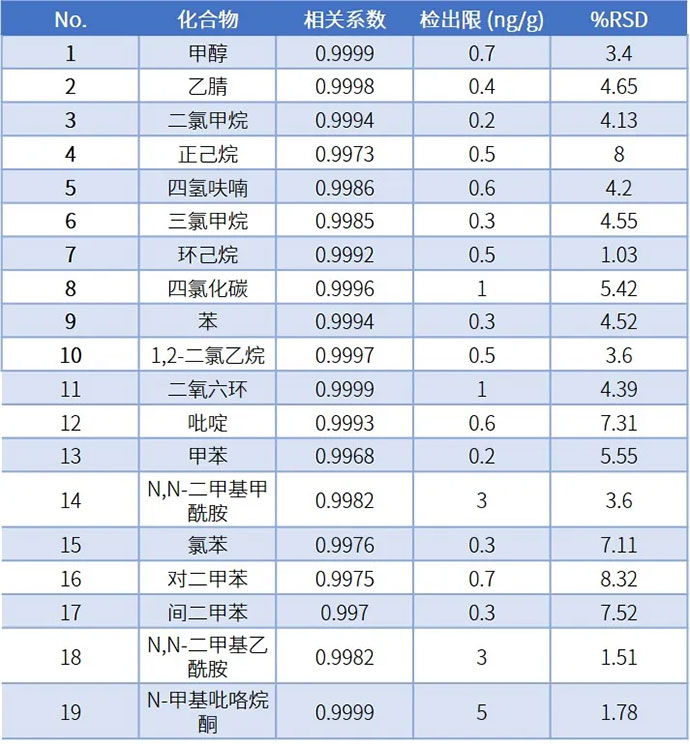
使用纯水配制溶剂残留混合标准系列溶液,每1mL含各种溶剂浓度分别为0.1、0.5、1.0、2.0、5.0µg,制作标准曲线,线性良好。根据0.1μg/mL标准溶液数据,计算方法检出限(3倍噪声计算)。各组分检出限均远低于通则限度1/1000以下,且峰面积重现性良好(顶空进样精密度RSD应达到10.0%以内)。
将溶剂残留混标溶液添加到市售小儿氨酚烷胺颗粒中,按照样品前处理方法制备,样品中加标浓度分别为0.5 μg,样品加标回收率为75 ~102%。
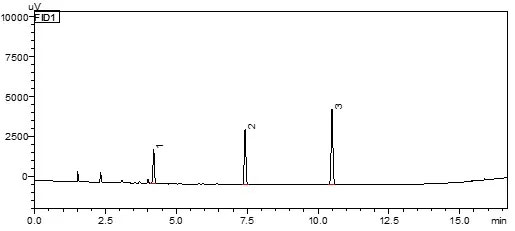
3 种溶剂残留混标溶液的色谱图(1.0 µg)
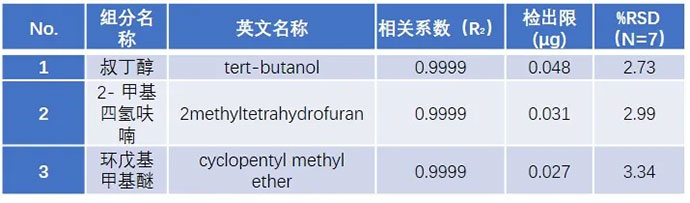
使用去离子水配制溶剂残留混合标准系列,每1mL含各种溶剂浓度分别为 0.1、0.2、0.5、1.0、2.0、5.0、10.0 µg 的混标系列溶液。根据 0.1 µg 标液数据,以 3 倍信噪比(ASTM)计算检出限,各物质线性相关系数及检出限、重复性(顶空进样精密度RSD应达到10.0%以内)测试结果如下表:
检测甲磺酸倍他司汀原料药,按照样品前处理方法制备,样品中加标浓度分别为0.2 μg,0.2 μg 加标平均回收率在 88.4%~97.4% 之间。
综上案例,岛津建立的气相及气质联用法可以用于分析药品中多种溶剂残留。



