解决方案 | 化药及药用辅料通则部分第一篇 粒度分布与颗粒形状测定
药用辅料指生产药品和调配处方时使用的赋形剂和附加剂,是除活性成分(API)或前体以外,是药物制剂的重要组成部分,是保证药物制剂生产和使用的物质基础,决定药物制剂性能及其安全性、有效性和稳定性。
2020年7月2日,国家药品监督管理局发布关于发布2020年版《中华人民共和国药典》的公告(2020年 第78号)”,明确新版药典于2020年12月30日起实施。新版药典更具科学性和规范性,增订《9603 预混与共处理药用辅料质量控制指导原则》,对《9601 药用辅料功能性相关指标指导原则》做了修订。
面对新版药典标准变化,岛津积极反馈,针对新修订标准内容进行了解读,并制定符合通则要求的应对方案,助力广大用户从容应对新标准。
标准解读
增修订变化
| 指导原则名称 | 增修订类型 | 内容变化 | 指导原则执行 |
| 9603预混与共处理药用辅料质量控制指导原则 | 增订 |
|
非强制执行,企业基于风险管理的理念,结合药用辅料本身特性及用途开展风险评估和风险防控 |
| 9601 药用辅料功能性相关指标指导原则 | 修订 |
|
非强制执行,药用辅料供应商及其用户自行评估需要研究的功能性相关指标,并明确研究方法 |
注:执行内容来源于公示稿原文
粒度项目在指导原则中收载情况
《9603 预混与共处理药用辅料质量控制指导原则》在功能性指标项目提到:采用适宜的方法,有针对性地建立适合预期功能的关键功能性检查项目,如“粒度与粒度分布”。
《9601 药用辅料功能性相关指标指导原则》公示稿中粒度研究项目在各类辅料功能性相关指标收载情况如下表:

粉体的颗粒粒度和粒度分布研究必要性
- 原料药的粒度分布(Particle Size Distribution,PSD),可能会对终产品的性能产生显著的影响,例如溶解度,粒子越小,比表面积越大,溶解性能就好。
- 原料药和辅料的粒度分布会影响药物可生产性,如流动性、总混均匀度、可压性等。
- 粉体的粒度分布对口服固体制剂生产过程中的每一步都有很大影响,包括预混合、混合、制粒等。
药典中粒度与粒度分布检测方法
2020年版《中国药典》在四部《0982 粒度和粒度分布测定法》中提供方法:
- 第一法:显微镜法
- 第二法:筛分法
- 第三法:光散射法,所用仪器为激光散射粒度分布仪,分为湿法测定和干法测定
光散射法原理:单色光束照射到颗粒供试品后即发生散射现象。由于散射光的能量分布与颗粒的大小有关,通过测量散射光的能量分布(散射角),依据米氏散射理论和弗朗霍夫近似理论,即可计算出颗粒的粒度分布。
解决方案
粒度分析

颗粒形状分析


药品粒度与形貌分析应用实例
2020年5月15日,国家药监局综合司发布《化学药品注射剂仿制药质量和疗效一致性评价技术要求》,在“质量研究与控制技术要求”明确提出应研究注射用粉末剂型的“复溶时间”。复溶时间的长短与粉末粒度大小和颗粒形状等因素密切相关。
注射用头孢曲松钠原研药和仿制药复溶时间测试
- 原研药20秒时全部溶解,倒置观察未见不溶颗粒,且溶液呈澄清透明状。
- 仿制药大量不溶,且存在较为明显的团聚颗粒,震荡至60秒仍有部分团聚颗粒存在,震荡至90秒全溶。全部溶解后,两者均呈淡黄色澄清溶液。
粒度分析
采用SALD-2300干法激光粒度仪分别对原研药和仿制药进行了粒径分布比较研究。
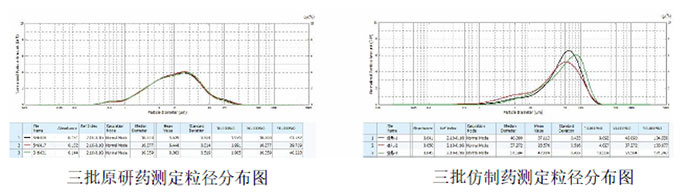
以上结果可见两者存在明显差异:原研药分布范围宽,但呈较好的均匀正态分布,不同生产批次间粒度分布均一稳定、精密度良好;仿制药粒径明显大于原研药,以45μm左右大粒径为主,且不同批次间差异较大。
颗粒形状
采用岛津电子探针显微分析仪(EPMA-1720)分别对原研药和仿制药进行了颗粒形貌观察比较研究。
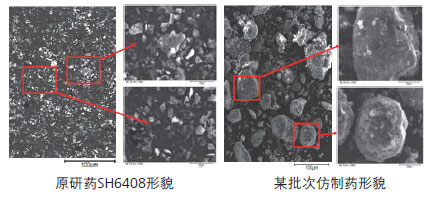
原研药主要以小的片状颗粒为主,偶尔会有少量松散团聚,比表面积大;而仿制药主要以大的块状结晶颗粒存在,表面存在比较密实的团聚,且不同生产批次间的差异明显。在颗粒形貌方面,两者差异显著,形貌结果与粒径分布结果相吻合。
注射用粉末的粒径、颗粒形貌或可作为指导主成分结晶工艺改进的指标,提升复溶时间的一致性。
参考文献:盖荣银等,注射用粉末剂型仿制药一致性评价关键技术要点解析,中国医药工业杂志,2019,50(2):226-228



