解决方案-元素杂质
存在于药品中的元素杂质有多种来源,生产过程中使用的原料药、辅料、生产设备、水和包装材料等均可能引入元素杂质,贮存过程中包装材料中的元素杂质还可能发生迁移而被引入药品中。这些元素杂质可能是有意添加引入(如原料药或辅料合成过程中有意添加的催化剂残留),也可能是无意引入(如与生产设备或包装系统相互作用产生的杂质或药品各个组分中存在的杂质)。为了治疗作用而有意添加到药品中的元素不属于元素杂质。因元素杂质不能为患者提供任何治疗作用,某些元素杂质甚至有一定毒性,所以它们在药品中的量需被控制在可接受的限度范围内。以符合制剂质量标准、生产质量管理规范(GMP)或其他质量要求。
通则0862概况
通则0862元素杂质是新版药典新增的重要通则,也是ICH Q3D(R2)在中国药典转化实施的重要内容之一。用基于风险的方法对元素杂质进行评估,对药品全生命周期内存在的元素杂质进行控制,提供了评估和控制药品中元素杂质的有关依据,以及元素杂质种类及其限度的确认方法,为元素杂质测定方法的选择、建立、验证和使用提供指导。以下是与ICH Q3D(R2)的对比情况,可供读者参考。
| 通则0862内容 | ICH Q3D(R2) | 对比说明 |
|---|---|---|
| 前言(未实际列出标题,包括元素杂质来源、定义、目的及适用范围的描述) | (1)前言(5.2)元素杂质的潜在来源 (2)范围 |
基本一致 |
| 1、风险评估中建议考察的元素 | (4)元素分类 (5.4)风险评估建议考虑的元素 (附录5)皮肤和透皮给药途径的元素杂质的限度 |
一致 |
| 2、形态 | (8)形态和其他考虑 (附录3)有关砷和汞的部分内容 |
一致 |
| 3、每日允许暴露量 | (3.4)注射剂 (附录2)元素杂质的既定PDE值 (附录5)皮肤和透皮给药途径的元素杂质的限度 |
一致 |
| 4、限度确认方法 | (7)PDE值与浓度限度的相互转换 | 有差异,但可与ICH Q3D(R2)方法对应,如下图 |
|
|
||
| 5、评估 | (5.5)评估 | 一致 |
| 6、控制阈值 | (5.6)风险评估过程总结 | 一致,将30%PDE(以及Ni和Co的CTCL)定义为控制阈值,作为元素杂质水平显著性的衡量指标,可用于判断药品中的元素杂质是否需要额外控制 |
| 7、元素杂质的控制 | (6)元素杂质的控制 | 一致,与检验标准有关的内容:建立原料药、辅料或物料(如合成中间体)、制剂的元素杂质标准限度;对药品中元素杂质进行定期检测 |
| 8、测定方法 | (9)分析方法 | 0862提供具体程序 |
有关测定方法:通则0862明确指出,任何可以满足质量控制要求的方法均可用于元素杂质的测定。检测方法包括但不限于电感耦合等离子体质谱法(通则0412)、电感耦合等离子体原子发射光谱法(通则0411)原子吸收分光光度法(通则0406)、X射线荧光光谱法(通则0461)、重金属检查法(通则0821)、检查法(通则0804)砷盐检查法(通则0822)等。上述方法通常测定的是不同形态元素的总量,若需区分元素的形态,可采用电感耦合等离子体质谱法与分离技术如液相色谱法联用的方法,或其他适宜的方法进行测定。涉及四个方面的重点内容汇总如下:
| 8.1供试品制备 | (1)不同的分析方法前处理存在差异,比如AA、ICP、ICPMS一般需要进行样品的消解,而EDX大部分情况下可以直接取样分析。 (2)取样还应均匀并具有代表性。 (3)通则提供以下供试品制备参考决策树。 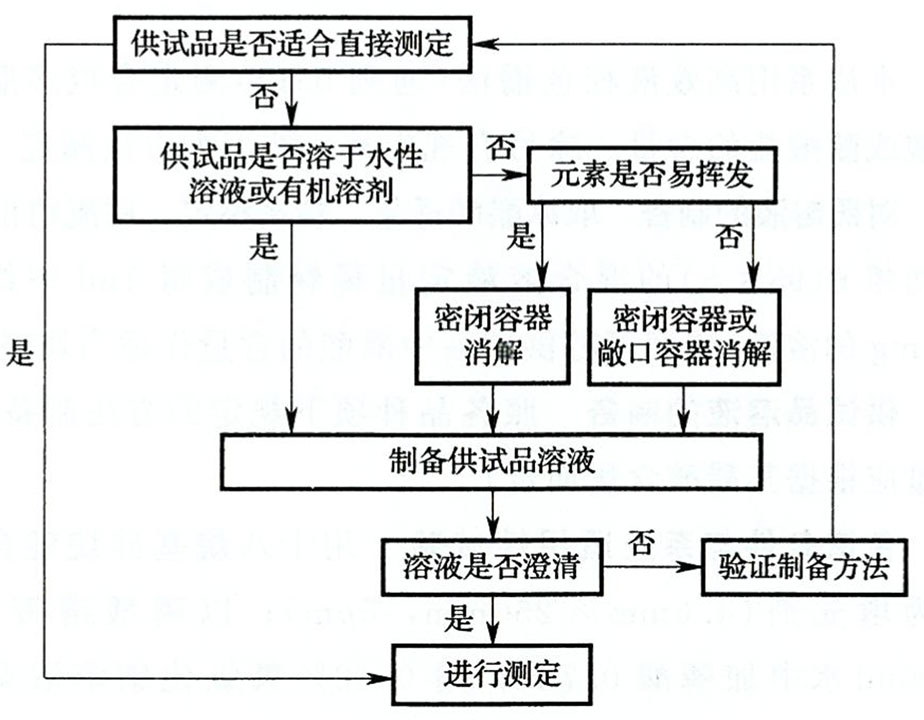 |
|---|---|
| 8.2方法选择 | (1)由于在灵敏度、专属性、线性范围、多元素同时测定等方面的优势,电感耦合等离子体质谱法通常还是同时测定多种痕量元素杂质的优选方法。 (2)元素杂质控制方法的选择主要取决于对元素杂质的控制要求、待测元素的性质和供试品的基质,可采用定量或限度检查等方法控制药品中的杂质量。 (3)定量方法包括外标法、内标法、标准加人法和标准曲线法等。 (4)必须注意背景干扰、基质效应、记忆效应和其他原因对测定的干扰。 (5)仪器分析参数的选择和设置可参考仪器制造商的说明书或操作指南。必须注意背景干扰、基质效应、记忆效应和其他原因对测定的干扰。 |
| 8.3方法验证 | (1)遵循9101分析方法验证指导原则,准确度和精密度试验要求以本通则为准。 (2)用于评价准确度和精密度的试验样品应采用与待测供试品下相同的方式制备测定 (3)专属性、线性及范围、准确度、精密度、定量限和检测限、耐用性均提出具体要求。 |
| 8.4 系统适用性 | (1)根据分析方法开发及其验证结果,特别是耐用性考察结果,如有必要且可能,应设立系统适用性试验及其要求,并在品种项下规定。 (2)方法转移和使用时,系统适用性试验应符合规定通常,定量测定时,在供试品溶液分析前后均需测定限度浓度的对照品溶液,对照品溶液复测后各元素响应值应为之前对照品溶液响应值的80%~120%;还应测定质控样品,可配制100%限度的回收率样品作为质控样品,测得的回收率应在 70%~150%之间。 (3)通则提供了限度浓度计算案例参考。 |
二部凡例相关修订变化
ICH Q3D在中国药典转化实施要求,体现在二部凡例的相关修订,也直接影响了产品标准执行变化。二部凡例新增了对化学药品元素杂质的整体要求,即“项目与要求”中的“第十七条”相关内容,明确提出风险评估及有效控制策略要求,对符合通则限度要求的,可不再进行品种正文规定的重金属、砷盐等元素杂质检查,包括但不限于药品制剂、原料药的检验。与2020年版内容对比如下:
| 2020年版ChP | 2025年版ChP |
|---|---|
| 无要求,在各论检查项中要求,重金属,砷盐,具体元素要求等 | (3)对于生产过程中使用的原料药、辅料、生产设备、水和包装材料等可能引入的元素杂质,以及贮存过程中包装材料迁移引入药品的元素杂质,药品生产企业均应按照元素杂质通则(通则 0862)的相关要求制定合理的检验方法以进行风险评估和控制,并符合相应元素杂质的限度要求。药品中已对元素杂质进行风险评估及有效控制并符合元素杂质通则(通则 0862)限度要求的,可不再进行品种正文规定的重金属、砷盐等元素杂质检查,包括但不限于药品制剂、原料药的检验。 |
目前《中国药典》收载重金属检查项的有529个品种,含有重金属和其他元素的有148个品种,有具体元素要求的有49个品种,后续会分步对二部相关品种进行元素杂质的风险评估,根据评估结果,修订相关品种的标准,第一批推荐试点品种有33个。
药品元素杂质检测解决方案
碳酸镧中29种元素杂质分析案例
岛津开发了快速测定碳酸镧制剂中29种元素杂质的分析方法。
碳酸镧(Lanthanum Carbonate)是一种口服的无钙脂磷结合剂。碳酸镧元素杂质分析方法开发面临一个重要挑战就是上机溶液中基体含有大量的稀土元素导致待测元素电离效率大大降低。镧(La)元素质量数包括138和139,同位素丰度分别为0.09%和99.91%,易在电感耦合等离子体中形成LaO*、LaH、LaAr*等多种多原子离子干扰物和双电荷干扰。
ICPMS-2050LF碰撞/反应池通过He气碰撞可去除大部分多原子离子干扰,并通过反应气消除氩基多原子离子,降低受干扰元素检出限。另外稀释是减少基体干扰的有效方式,除将样品稀释到合适的浓度外,ICPMS-2050LF具有稀释气辅助功能,在减少载气的同时使用氩气对气溶胶液滴进行稀释降低等离子体中的基体浓度,从而减少干扰。

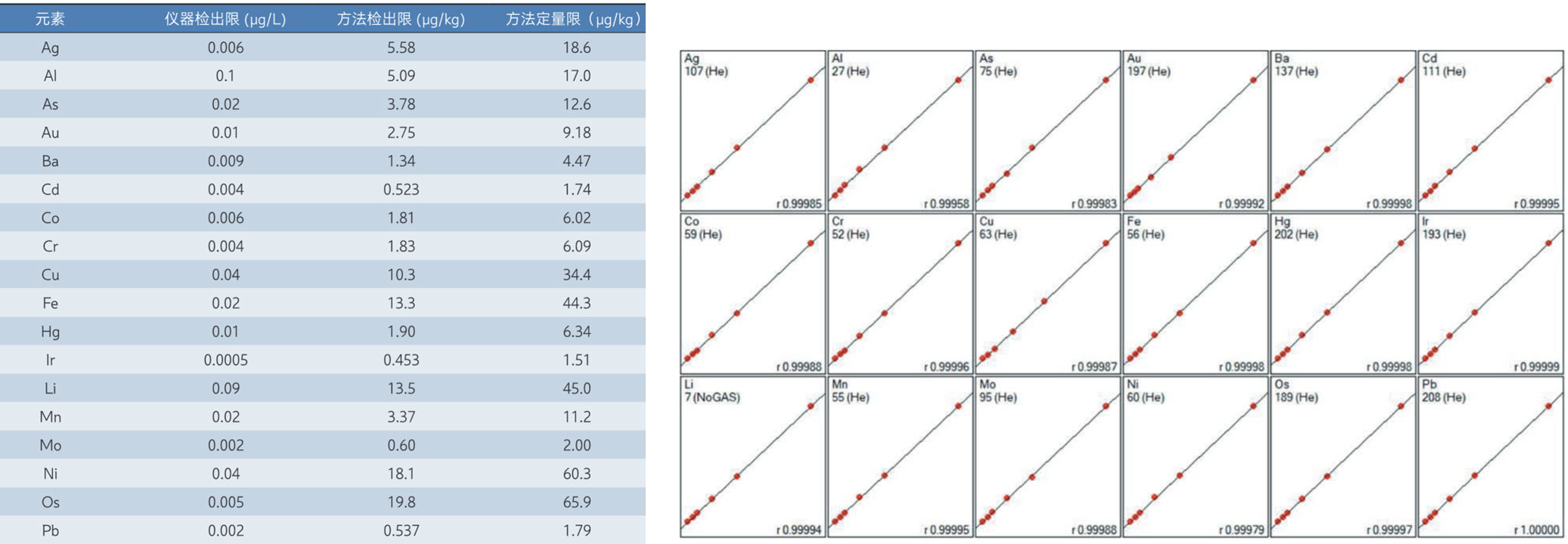
使用岛津电感耦合等离子体质谱仪ICPMS-2050LF对碳酸镧中29种元素杂质进行准确分析。该方法检出限低,线性良好(r>0.999),准确度高,重复性良好。可以为企业相关品种元素杂质风险评估的方法开发提供参考。
X射线荧光光谱法快速定量某口服固体制剂中7种元素杂质
XRF法是近年来发展起来的一种元素检测方法,为无损分析技术,大多数样品可直接测定,适用于固体、粉末和液体样品中元素的定性和定量测定。XRF收载于USP通则<735>,也收载于2020年版《中国药典(四部)》通则0461,可作为药品元素杂质风险评估的替代分析方法,因此本方法收载入新通则0862中。
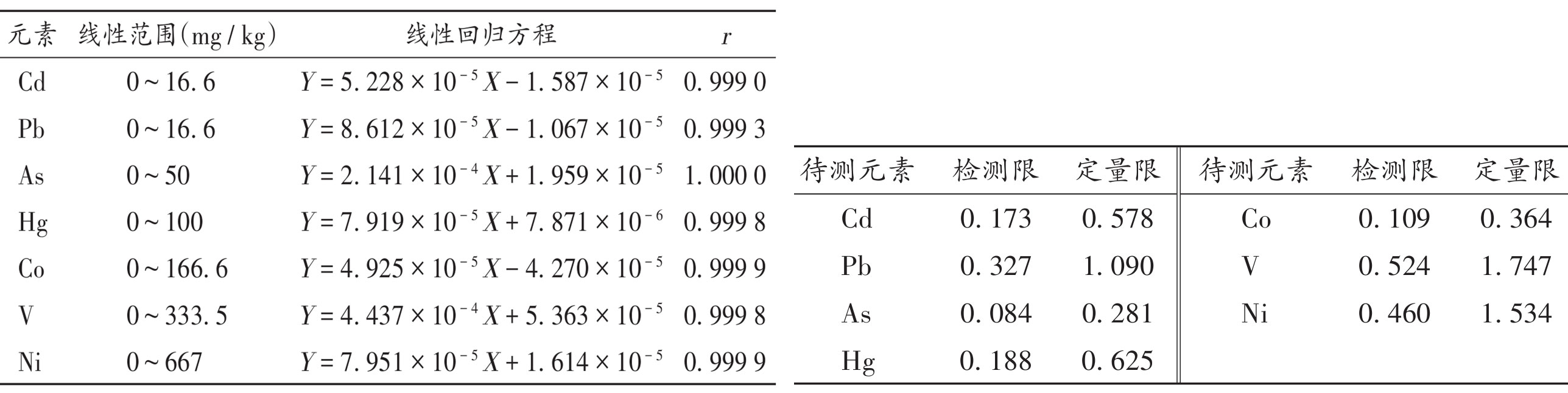
XRF法突出的优点是检测元素范围广、前处理简便、无污染,且为无损检测,适合快速筛查。据报道,XRF法测定药品中的元素杂质,但由于不同药品的服用剂量差异巨大,根据每日暴露量(PDE)值计算的限度浓度差异大,且不同药品的基质不同,XRF法可能会存在基质干扰。在建立方法时,需考察XRF法对不同药物的适用性。岛津与某省级药检院联合开发了ED-XRF快速定量某固体制剂中7种元素杂质的分析方法【1】,该方法操作简便,可直接快速定量该品种的元素杂质的风险评估。通过专属性试验、线性关系、检测限与定量限确定、准确度与精密度试验以及耐用性试验进行方法学考察。此外,对元素杂质风险评估、方法优化与验证、形态选择以及方法评价方面进行讨论。具体内容可参考文献信息。
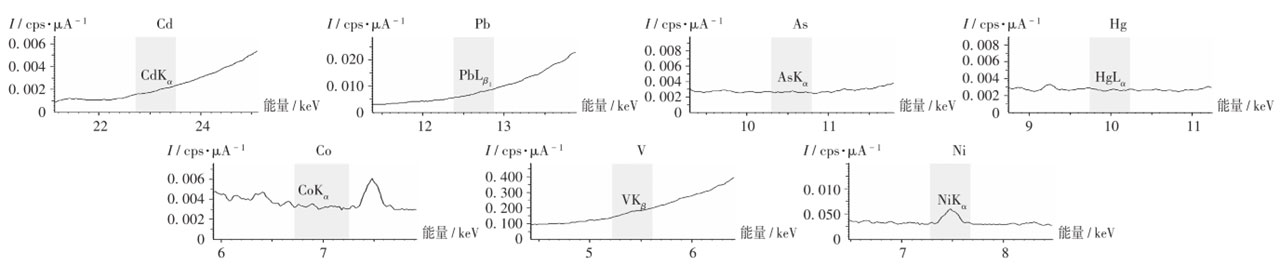
空白溶剂的光谱图(专属性试验)
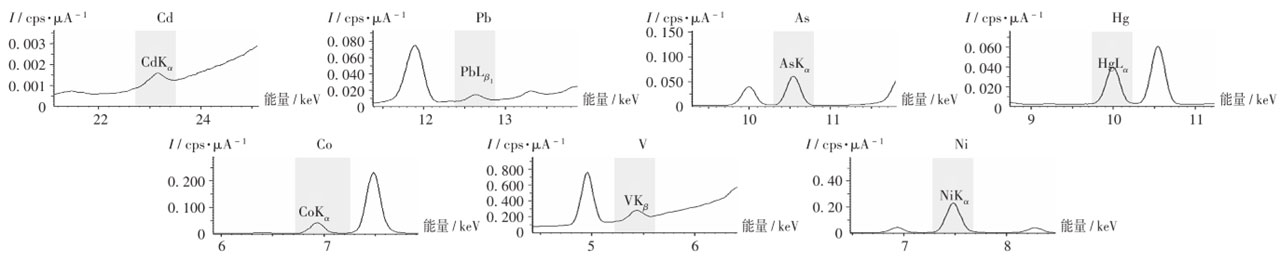
供试品的光谱图(专属性试验)
参考文献资料:
【1】刘荷英,盖荣银,张敏,等.X射线荧光光谱法快速定量桂利嗪片中7种元素杂质[J],中国药业,2024,33(7)