解决方案-残留溶剂
药品中的残留溶剂系指在原料药或辅料的生产中,以及在制剂制备过程中使用的,但在工艺过程中未能完全除去的有机挥发性化合物。当药品所含的残留溶剂水平高于安全值时,就会对人体或环境产生危害,应尽可能除去所有残留溶剂,以符合制剂质量标准、生产质量管理规范(GMP)或其他质量要求。2025年版《中国药典》对二部凡例相关要求以及通则0861进行了重要修订,产品标准应按凡例及通用技术要求进行充分风险评估。
二部凡例相关修订变化
ICH Q3C(R9)在中国药典转化实施要求,体现在二部凡例的相关修订,也直接影响了产品标准执行变化。本次二部凡例修订了对化学药品残留溶剂的整体要求,即“项目与要求”中的“第十七条”相关内容,明确提出风险评估及有效控制策略要求,对符合通则限度要求的可不再进行品种正文规定的检查,如果第二类溶剂限度按方法2确定则需审批后使用。与2020年版内容对比如下:
| 2020年版ChP | 2025年版ChP |
|---|---|
| 对于生产过程中引入的有机溶剂,应在后续的生产环节予以有效去除。除正文已明确列有"残留溶剂"检查的品种必须对生产过程中引入的有机溶剂依法进行该项检查外,其他未在"残留溶剂"项下明确列出的有机溶剂或未在正文中列有此项检査的各品种,如生产过程中引入或产品中残留有机溶剂,均应按通则"残留溶剂测定法"检查,并应符合相应溶剂的限度规定 | 对于生产过程中使用或产生的有机挥发性化合物,应在后续的生产环节予以有效去除。药品中残留的有机挥发性化合物,药品生产企业均应按照残留溶剂(通则0861)的相关要求制定合理的检验方法以进行风险评估和控制,并符合相应有机挥发性化合物的限度要求。药品中已对残留的有机挥发性化合物进行风险评估及有效控制并符合残留溶剂(通则0861)限度要求的,可不再进行品种正文规定的残留溶剂检查,其中第二类溶剂限度如需采用方法2进行确定,应经国务院药品监督管理部门批准后方可使用。 |
通则0861修订变化
2025年版《中国药典》通则0861迎来重要修订,本次修订是ICH Q3C(R9)在中国药典转化实施的重点内容之一,修订本通则,与ICH Q3C(R9)更加协调。基于风险评估和过程控制的理念,对在技术上不可避免使用的溶剂提出了评估和检查的建议,提供了原料药、辅料和制剂残留溶剂的评估与测定的方法。与2020年版对比情况如下,供读者参考。
| 2020年版ChP | 2025年版ChP | 修订说明汇总 |
|---|---|---|
| 0861残留溶剂测定法 | 0861残留溶剂 | 修订通则名称 |
| 定义:是指在原料药或辅料的生产中,以及在制剂制备过程中使用的,但在工艺过程中未能完全去除的有机化合物。 | 定义:是指在原料药、辅料或制剂生产过程中使用或产生的,并在实际工艺过程中不能完全除去的有机挥发性化合物 | 有修订,同ICH Q3C(R9)定义协调 |
| / | 评估与控制的一般原则 | 新增,引入Q3C(R9)的内容,本通则还强调:由于不同生产企业或不同工艺所用溶剂种类可能存在差异,无论各品种正文中是否设置残留溶剂检查项,生产企业均应基于本通则的要求,遵循质量风险管理原则,结合生产工艺,对使用或可能产生的残留溶剂,采用本通则推荐的方法或其他经验证、核准的方法进行测定和控制,使残留溶剂量符合本通则规定的限度要求。 |
| / | 评估与控制:基于风险评估的残留溶剂分类 | 新增,协调Q3C(R9)的内容 |
| / | 评估与控制:残留溶剂的限度 | 新增,协调Q3C(R9)的内容,强调表中列出的溶剂分类及其建议限度来源于ICH Q3C(R9),且将随安全性数据更新和ICH Q3C(R9)版本的更新而变更 |
| / | 评估与控制:第二类溶剂限度的确定方法 | 新增,协调Q3C(R9)的内容 |
| / | 评估与控制:残留溶剂的报告方式 | 新增,协调Q3C(R9)的内容 |
| 测定方法 | 测定方法 | 新增概述,药品中残留溶剂的鉴别、限度检查和定量测定通常采用色谱技术如气相色谱法。可采用本通则推荐的方法,或选择与药品生产特定情况相适应的经验证的分析方法。当仅有第三类溶剂存在时,也可采用经适当验证的非专属性方法进行检查,如干燥失重检查法。验证时应考虑溶剂挥发性对分析方法的影响。 |
| 色谱柱 | 色谱柱 | 少量文字修订 |
| 供试品溶液的制备 | 供试品溶液的制备 | 有修订 |
| 对照品溶液的制备 | 对照品溶液的制备 | 有修订 |
| 测定法(第一法、第二法、第三法) | 测定法(第一法、第二法、第三法) | 有修订 |
| 系统适用性试验 | 系统适用性试验 | 理论塔板数:删除原具体数值要求, 补充了在柱效影响分离效能时,可规定色谱柱应达到的最小理论板数。 分离度:删除具体要求,增加必要时可用峰谷比描述 增加了对称性、灵敏度、重复性相关内容的描述 |
| / | 残留溶剂的鉴别 | 增加内容,提供两种鉴别方法,保留时间删除了RART列表。 强调两个保留时间不同的色谱峰归属于不同化合物,但两个保留时间一致的色谱峰有时未必可归属为同一化合物,在作未知物定性分析时应特别注意。 |
| / | 残留溶剂的检查和定量 | 原通则0861的“计算法”的内容整合至“残留溶剂的检查和定量”中,增加了对第三类溶剂的测定。 列出两种方法:限度检查内标法(峰面积比)外标法(峰面积),定量测定按外标法或内标法计算残留溶剂的量。特别注意对第三类溶剂的鉴别根据需要进行检查。另外结合残留溶剂的测定,给出分析策略图。 |
| 附注 | 分析方法建立和使用中的其它考虑(1)~(10) | 对原“【附注】内容进行整理,删除了利用保留值定性的内容,增加了(5)和(6)。 (1)采用等温法和程序升温法的考虑,无修订 (2)顶空条件选择的考虑,将平衡时间由30-45分钟修订为30-60分钟,新增对平衡温度的考虑 (3)沸点较高的残留溶剂的测定,删除顶空的相关描述 (4)含氮的碱性残留溶剂的测定,将“化合物”修订为“残留溶剂” (5)新增,含羧酸的酸性残留溶剂的测定 (6)新增,流速的选择 (7)检测器选择的考虑,无修订 (8)干扰峰的排除,少量文字修订 (9)定量方法的验证,无修订 (10)仲裁方式,以内标法或标准加入法的结果为准,无修订 |
| 附表(1-3) | 表1-4 | 删除了原附表1-3 根据ICH Q3C的溶剂分类,新增了表1~表4,内容包括溶剂的分类、各溶剂的PDE值、限度(ppm)以及CAS号等信息 |
通则0861残留溶剂与ICH《IMPURITIES:GUIDELINE FOR RESIDUAL SOLVENTS Q3C(R9)》核心内容进行了充分协调,在测定法方面有着中国药典的特色,具有很强的指导价值。ICH Q3C(R9)于2024年1月24日进行了更新,通过第3.4节(第4页)的微小修订案,该修订包含对分析方法中溶剂挥发性的考量。
药品残留溶剂检测解决方案

药品残留溶剂检测典型应用实例
< HS-GC法测定药品中18种溶剂残 >
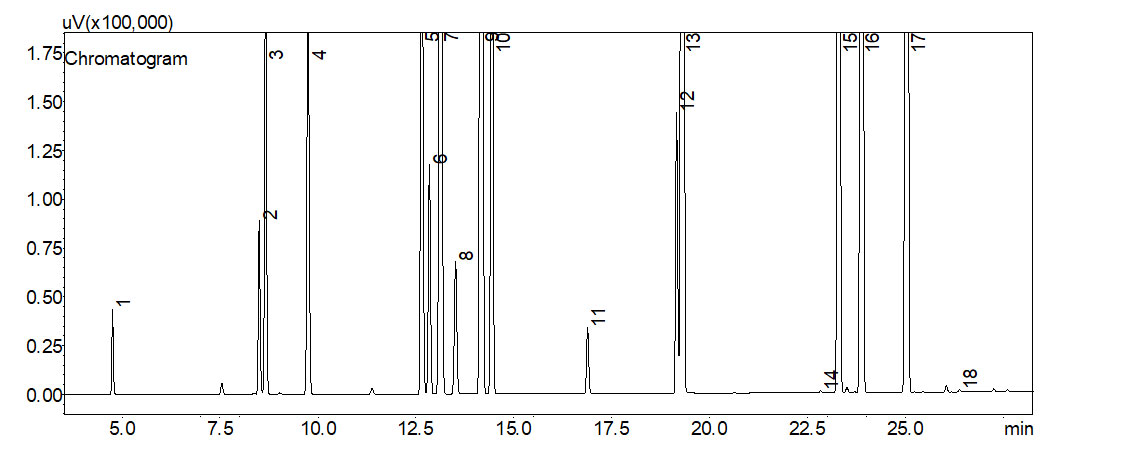
18种溶剂标准溶液色谱图
使用纯水配制溶剂残留混合标准系列溶液制作标准曲线。根据0.1μg/mL标准溶液数据,计算方法检出限。
| No. | 化合物 | 相关系数 | 检出限 (µg/g) | %RSD | No. | 化合物 | 相关系数 | 检出限 (µg/g) | %RSD |
|---|---|---|---|---|---|---|---|---|---|
| 1 | 甲醇 | 0.9998 | 0.131 | 2.69 | 10 | 1,2-二氯乙烷 | 0.9993 | 0.008 | 4.72 |
| 2 | 乙腈 | 0.9999 | 0.060 | 3.15 | 11 | 二氧六环 | 0.9998 | 0.165 | 6.22 |
| 3 | 二氯甲烷 | 0.9994 | 0.020 | 5.06 | 12 | 吡啶 | 0.9997 | 0.043 | 2.03 |
| 4 | 正己烷 | 0.9965 | 0.040 | 1.53 | 13 | 甲苯 | 0.9995 | 0.001 | 1.51 |
| 5 | 四氢呋喃 | 0.9997 | 0.012 | 3.85 | 14 | N,N-二甲基甲酰胺 | 0.9994 | 6.194 | 4.46 |
| 6 | 三氯甲烷 | 0.9996 | 0.044 | 6.92 | 15 | 氯苯 | 0.9991 | 0.002 | 6.94 |
| 7 | 环己烷 | 0.9979 | 0.012 | 4.22 | 16 | 对二甲苯 | 0.9986 | 0.001 | 4.36 |
| 8 | 四氯化碳 | 0.9992 | 0.101 | 1.41 | 17 | 间二甲苯 | 0.9984 | 0.001 | 3.60 |
| 9 | 苯 | 0.9996 | 0.002 | 3.57 | 18 | N,N-二甲基乙酰胺 | 0.9979 | 7.274 | 8.26 |
实际测试市售某品牌的小儿氨酚烷胺颗粒,按样品前处理方法制备,并进行回收率测试。
| 序号 | 化合物名称 | 检测结果 (μg/g) |
回收率% | RSD% (n=3) |
化合物名称 | 检测结果 (μg/g) |
回收率% | RSD% (n=3) |
化合物名称 | 检测结果 (μg/g) |
回收率% | RSD% (n=3) |
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 1 | 甲醇 | N.D | 99.86 | 1.48 | 环己烷 | N.D | 96.26 | 3.23 | 甲苯 | N.D | 98.37 | 1.49 |
| 2 | 乙腈 | N.D | 100.44 | 1.79 | 四氯化碳 | N.D | 97.42 | 2.25 | N,N-二甲基甲酰胺 | N.D | 117.46 | 8.32 |
| 3 | 二氯甲烷 | N.D | 100.02 | 0.47 | 苯 | N.D | 98.74 | 1.21 | 氯苯 | N.D | 98.94 | 1.1 |
| 4 | 正己烷 | N.D | 87.89 | 9.47 | 1,2-二氯乙烷 | N.D | 100.74 | 0.75 | 对二甲苯 | N.D | 96.96 | 2.78 |
| 5 | 四氢呋喃 | N.D | 101.33 | 1.47 | 二氧六环 | N.D | 100.96 | 1.65 | 间二甲苯 | N.D | 97.55 | 2.4 |
| 6 | 三氯甲烷 | N.D | 99.37 | 0.79 | 吡啶 | 2.49 | 113.3 | 5.75 | N,N-二甲基乙酰胺 | N.D | 94.12 | 5.11 |
采用岛津HS-20顶空进样器结合气相色谱仪分析药品中的溶剂残留,方法操作简单,在0.1~5µg标准曲线范围内线性良好,样品加标回收率为87.89~117.46%。本方法可以用于药品中的溶剂残留定性定量检测。
常用色谱柱选型方案及应用文集
| 产品 | 固定相 | 适合范围 |
|---|---|---|
| SH-5 | 5%二苯基/95%二甲基聚硅氧烷 | 磺酸酯类基因毒性杂质、多环芳烃、环氧乙烷、高沸点残留溶剂杂质 |
| SH-I-624Sil MS | 6%氰丙基苯基/94%二甲基聚硅氧烷 | 乙醇挥发性杂质、残留溶剂(优选)、环氧乙烷 |
| SH-PolarWax | 聚乙二醇 (PEG) | 脂肪酸组成、亚硝胺类、磺酸酯类基因毒性杂质、醇酯等极性较强残留溶剂分析、极性原料溶剂纯度分析 |
| SH-Volatil Amin | 碱性化处理的100%二甲基聚硅氧烷 | 胺类溶剂残留分析,同时可应用于醇类、游离酸、酯、胺类混合检测 |
| SH-PolarD | 硝基对苯二甲酸改性的聚乙二醇 | 酸性溶剂残留分析,游离酸、醇、酯类 |
| Shim-pack Scepter C18 | 十八烷基硅烷 | 液相方法通用柱,耐受pH 1-12,可用于分析酸性残留溶剂 |

如有需要,请联系岛津SGLC(400-920-7730)获取最新样本。



