解决方案-人用重组单克隆抗体(总论)及单抗生物类似药(增订各论)分析
1. 人用重组单克隆抗体制品简介
人用重组单克隆抗体制品,系指采用各种单克隆抗体筛选技术、重组DNA技术及细胞培养技术制备的单克隆抗体治疗药物,包括完整免疫球蛋白、具有特异性靶点的免疫球蛋白片段、基于抗体结构的融合蛋白、抗体偶联药物等。其作用机制是通过与相应抗原的特异性结合,从而直接发挥中和或阻断作用,或者间接通过Fc效应子发挥包括抗体依赖和补体依赖细胞毒作用等生物学功能。
人用重组单克隆抗体制品具有复杂的质量属性,本总论以哺乳动物细胞大规模培养技术制备的IgG型单克隆抗体制品为重点,阐述人用重组单克隆抗体制品生产和质量控制的通用性技术要求。具体品种还应同时符合"人用重组DNA蛋白制品总论"与抗体制品相应各论的要求。
人用重组单克隆抗体制品质量控制应根据制品关键质量属性、对制品和工艺理解认识的积累和风险评估的原则制定,应根据重组单克隆抗体制品内在固有质量属性的差异与不同,确定制品的关键质量属性(CQA),选择相应适宜的分析方法开展质量检定(见表1)。
注:以下内容根据2025年版《中国药典》说明整理。
表1 人用重组单克隆抗体制品质量控制及制品检定要求
| 序号 | 分析项目 | 详细内容 | 检测方法 |
|---|---|---|---|
| 1 | 鉴别与一致性分析外观 | 鉴别 | 毛细管区带电泳(CZE),毛细管等电聚焦电泳(cIEF),离子交换高效液相色谱(IEX-HPLC),肽图,生物和(或)免疫学等方法中的一种或一种以上方法 |
| 糖基化修饰分析 | 毛细管电泳(CE),高效液相色谱(HPLC)等 | ||
| 2 | 纯度和杂质 | 分子大小变异体(单体、聚合体或片段;具备Fc效应子功能需关注非糖基化重链情况) | 非还原型或还原型SDS-聚丙烯酰胺凝胶电泳(SDS-PAGE)或SDS-毛细管电泳(CE-SDS)、分子排阻色谱法(SEC)等 |
| 电荷变异体 | 毛细管等电聚焦电泳(cIEF),离子交换高效液相色谱(IEX-HPLC),疏水高效液相色谱(HIC-HPLC)、反相高效液相色谱(RP-HPLC)等 | ||
| 制品相关杂质 (氧化产物、脱酰胺产物或其他结构不完整分子) | 适宜的方法定量分析 | ||
| 工艺相关杂质(宿主蛋白质、宿主细胞和载体DNA、蛋白A及其他工艺相关杂质) | 适宜的方法进行检测 | ||
| 3 | 效价 | 生物学活性 | 相应的生物学测定方法和数据分析模式 |
| 结合活性(预期的作用靶点和作用机制) | 相应的结合活性测定方法和数据分析模式 | ||
| 4 | 含量 | 总蛋白质含量 | 分光光度法等,并建议采用第二种含量测定的绝对溯源方法进行验证 |
| 5 | 其他检定 | 无菌检查 | 薄膜过滤法(通则1101) |
| 细菌内毒素检查 | 动态显色法(通则1143) | ||
| 6 | 修饰抗体的检测 | 修饰效果、比率或工艺杂质 | 适合的方法 |
2. 增订各论单抗生物类似药检测要求
本版药典结合临床应用实际,进一步扩大了抗体药物收载范围,新收载5个抗体类药物品种,加快近年来国内具有领先优势的已上市品种和相关技术向国家标准转化。下面以"注射用曲妥珠单抗"为例,详细介绍单抗生物类似药检测要求。
注射用曲妥珠单抗在治疗多种HER2阳性的癌症中发挥着重要作用。曲妥珠单抗的作用机制主要是抑制PI3K/AKT信号通路、诱导细胞周期阻滞、介导抗体依赖的细胞介导的细胞毒作用(ADCC)、抑制DNA损伤修复、抑制血管生成及诱导免疫应答等。当HER2蛋白膜内段的酪氨酸残基磷酸化后,能激活多种信号转导通路,这些通路的异常与肿瘤的生长密切相关。曲妥珠单抗特异性地作用于HER2蛋白的细胞外IV区,通过多种机制抑制肿瘤细胞的生长和增殖,包括阻断HER2同源二聚体和异源二聚体的形成、介导HER2受体的内吞和降解、阻断特定信号通路、诱导细胞周期停滞、促进肿瘤细胞凋亡、抗肿瘤血管生成、诱导抗体依赖细胞介导的细胞毒作用等。
曲妥珠单抗(Trastuzumab),1998年由美国食品与药物管理局批准上市,2002年我国批准用于治疗HER2阳性转移性乳腺癌。截至2024年9月底,国内已有5家企业生产的注射用曲妥珠单抗获批上市,其中复宏汉霖有两个规格的产品获批。这些产品的上市为HER2阳性的乳腺癌和胃癌患者提供了更多的治疗选择。
曲妥珠单抗是一种人源化单克隆抗体,系由含有可高效表达曲妥珠单抗基因的中国仓鼠卵巢(CHO)细胞,经细胞培养、分离和高度纯化后获得的曲妥珠单抗无菌冻干品。该注射液的质量标准涵盖多个检测项目,质量标准摘录见表2。
注:以下内容根据2025年版《中国药典》说明整理。
表2 注射用曲妥珠单抗质量标准
| 检测项目 | 检测方法 | 质量标准 |
|---|---|---|
| 外观 | 直接观察法 | 应为白色至淡黄色冻干疏松块状物 |
| 鉴别一等电点 | 单抗电荷变异体测定法(通则3129) | 供试品溶液主峰等电点与对照品溶液主峰等电点差异应不大于 0.2 |
| 复溶时间 | 参考中国药典 | 取本品5瓶,每瓶按说明书标示量加入灭菌注射用水,均应于3分钟内完全溶解 |
| pH | 通则 0631pH 值测定法 | 5.4~6.6 |
| 溶液的澄清度与颜色 | 通则 0902 澄清度检查法 | 应澄清无色。如显浑浊,与2号浊度标准液(通则 0902)比较,不得更浓;如显色,与黄色2号标准比色液(通则 0901第一法)比较,不得更深 |
| 水分 | 水分测定法(通则 0832 第一法 1) | 不得过 3.0% |
| 渗透压摩尔浓度 | 通则 0632 渗透压摩尔浓度测定法 | 应为 45~75mOsmol/kg |
| 装量差异 | 注射剂(通则 0102) | 应符合规定 |
| 可见异物 | 通则 0904 可见异物检查法 | 应符合规定 |
| 不溶性微粒 | 通则 0903 第一法光阻法 | 应符合规定 |
| 纯度(1)分子排阻色谱法 | 分子排阻色谱法(通则 0514) | 曲妥珠单抗含量不得小于 95.0%,聚体含量不得大于 2.0% |
| 纯度(2)离子交换色谱法 | 高效液相色谱法(通则 0512) | 应符合规定 |
|
纯度(3)非还原毛细管凝胶 电泳法 |
单抗分子大小变异体测定法(通则 3127第一法) | 曲妥珠单抗主峰的修正峰面积不得小于修正总峰面积的 90.0% |
| 纯度(4)还原毛细管凝胶电泳法 | 单抗分子大小变异体测定法(通则 3127第一法) | 曲妥珠单抗轻链与重链的修正峰面积之和不得小于总修正峰面积的95.0%,非糖基化重链的修正峰面积不得大于总修正峰面积的 2.0% |
| 聚山梨酯 20 含量(如有) | 高效液相色谱法(通则 0512) | 每 1m|中含聚山梨酯 20 应为 0.05~0.15mg |
| 异常毒性 | 通则 1141 小鼠试验法 | 应符合规定 |
| 无菌 | 通则 1101 薄膜过滤法 应符合规定 | 应符合规定 |
| 细菌内毒素 | 动态显色法(通则 1143) | 每瓶中含内毒素的量应小于 5EU(规格:60mg)、12EU(规格主150mg)、36 EU(规格:440mg) |
| 生物学活性 | 通则 3538 曲妥珠单抗生物学活性测定法 | 生物学活性应为标准品的 75%~130% |
| 含量测定 | 蛋白质含量测定法(通则 0731 第六法) | 每瓶中蛋白质含量分别应为 55~75mg(规格:60mg)、132~180mg(规格:150mg)、405~475mg(规格:440mg) |
另外,英夫利西单抗、阿达木单抗、贝伐珠单抗和利妥昔单抗注射液的质量标准摘录见表3-6。
表3 注射用英夫利西单抗质量标准
| 检测项目 | 检测方法 | 质量标准 |
|---|---|---|
| 外观 | 直接观察法 | 应为白色疏松体 |
| 鉴别一等电点 | 单抗电荷变异体测定法(通则3129) | 供试品溶液主峰等电点与对照品溶液主峰等电点差异应不大于 0.2 |
| 复溶时间 | 参考中国药典 | 取本品3瓶,每瓶加水10ml,均应于2分钟内溶解 |
| pH | 通则 0631pH 值测定法 | 6.9~7.5 |
| 溶液的澄清度与颜色 | 通则 0902 澄清度检查法 | 应澄清无色。如显浑浊,与2号浊度标准液(通则 0902)比较,不得更浓; 如显色,与黄色3号标准比色液(通则 0901第一法)比较,不得更深 |
| 水分 | 水分测定法(通则 0832 第一法 ) | 不得过 3.0% |
| 渗透压摩尔浓度 | 通则 0632 渗透压摩尔浓度测定法 | 应符合规定 |
| 装量差异 | 注射剂(通则 0102) | 应符合规定 |
| 可见异物 | 通则 0904 可见异物检查法 | 应符合规定 |
| 不溶性微粒 | 通则 0903 第一法光阻法 | 应符合规定 |
| 纯度(1)分子排阻色谱法 | 分子排阻色谱法(通则 0514) | 英夫利西单抗含量不得小于 98.0% |
| 纯度(2)电荷变异体 方法一:阳离子交换色谱法 |
高效液相色谱法(通则 0512) | 英夫利西单抗主峰不得小于60%,酸性组分不得大于35%,碱性组分不得大于10% |
|
纯度(2)电荷变异体 |
单抗电荷变异体测定法(通则3129第一法) | 英夫利西单抗主峰应为58%~80%,酸性组分应为18%~40%,碱性组分不得大于5% |
| 纯度(3)非还原毛细管凝胶电泳法 | 单抗分子大小变异体测定法(通则 3127第一法) | 英夫利西单抗主峰的修正峰面积不得小于修正总峰面积的 90.0% |
| 纯度(4)还原毛细管凝胶电泳法 | 单抗分子大小变异体测定法(通则 3127第一法) | 英夫利西单抗轻链与重链的修正峰面积之和不得小于总修正峰面积的96.0%,非糖基化重链的修正峰面积不得大于总修正峰面积的4.0% |
| 聚山梨酯 80 含量(如有) | 聚山梨酯80测定法(通则3203) | 应符合规定 |
| 异常毒性 | 通则 1141 小鼠试验法 | 应符合规定 |
| 无菌 | 通则 1101 薄膜过滤法 | 应符合规定 |
| 细菌内毒素 | 动态显色法(通则 1143) | 每瓶中含内毒素的量应小于 5EU(规格:60mg)、12EU(规格主150mg)、36 EU(规格:440mg) |
| 生物学活性 | 通则 3539 英夫利西单抗生物学活性测定法 | 生物学活性应为标准品的80%~120% |
| 含量测定 | 紫外-可见分光光度法(通则0401) | 应为标示量的90%~110% |
表4 阿达木单抗注射液质量标准
|
检测项目 |
检测方法 |
质量标准 |
|---|---|---|
| 外观 | 直接观察法 | 应为无色或微黄色澄明液体。 |
| 鉴别(1) 等电点 | 单抗电荷变异体测定法(通则3129) | 供试品图谱应与对照品图谱一致, 主峰等电点与对照品主峰等电点的差值应不大于0.2。 |
| 鉴别(2)阳离子交换色谱法 | 高效液相色谱法(通则0512) | 供试品溶液应与对照品溶液一致, 两图中赖氨酸变异体Lys0 峰保留时间的比值应为0.9~1.1。 |
| pH | 通则0631 | 应符合规定 |
| 澄清度 | 通则0902 | 可略带乳光, 应不高于4号浊度标准液。 |
| 渗透压摩尔浓度 | 通则0632 冰点下降法 | 应符合规定 |
| 可见异物 | 通则0904 第一法直接观察法 | 应符合规定 |
| 不溶性微粒 | 通则0903 第一法光阻法 | 应符合规定 |
| 装量 | 注射剂(通则0102) 重量法 | 应不低于标示量。 |
| 纯度与杂质(1)分子排阻色谱法 | 单抗分子大小变异体测定法(通则3127 第二法) | 限度阿达木单抗含量应不低于98.0% |
| 纯度与杂质(2)阳离子交换色谱法 | 高效液相色谱法(通则0512) | 限度赖氨酸变异体含量应不低于 75.0%,酸性组分含量应不大于25.0%。 |
| 纯度与杂质(3)非还原 毛细管凝胶电泳法 |
单抗分子大小变异体测定法(通则3127 第一法) | 限度供试品图谱应与对照品图谱一致, 阿达木单抗峰的修正峰面积不得小于总修正峰面积的90.0%。 |
| 纯度与杂质(4) 还原毛细管凝胶电泳法 | 单抗分子大小变异体测定法(通则3127 第一法) | 限度阿达木单抗轻链与重链的修正峰面积之和不得小于总修正峰面积的95.0%。 |
| 聚山梨酯 80 含量(如有) | 聚山梨酯80测定法(通则3203 第二法) | 应符合规定 |
| 细菌内毒素 | 动态显色法(通则1143) | 每1mg阿达木单抗含内毒素的量应不高于0.2EU |
| 无菌 | 通则1101 薄膜过滤法 | 应符合规定 |
| 异常毒性 | 通则1141 小鼠试验法 | 应符合规定 |
| 生物学活性 | 通则3540 阿达木单抗生物学活性测定法 | 供试品生物学活性应为标准品的80%~125%。 |
| 含量测定 | 蛋白质含量测定法(通则0731 第六法) | 每瓶含阿达木单抗应为标示量的90%~110%。 |
表5 贝伐珠单抗注射液质量标准
| 检测项目 | 检测方法 | 质量标准 |
|---|---|---|
| 鉴别(1)肽图 | 肽图检查法(通则3405) | 供试品溶液图谱应与对照品溶液图谱一致 |
| 鉴别(2)等电点 | 单抗电荷变异体测定法(通则3129 第一法) | 供试品溶液图谱应与对照品溶液一致,供试品溶液主峰和对照品主峰溶液的等电点差值不得大于0.2 |
| 颜色 | 通则 0901溶液颜色检查法 | 应符合规定 |
| 澄清度 | 通则0902澄清度检查法 | 与3号浊度标准液比较,不得更浓 |
| pH | 通则0631pH值测定法 | 应符合规定 |
| 渗透压摩尔浓度 | 通则0632渗透压摩尔浓度测定法 | 应符合规定 |
| 装量 | 注射剂(通则0102) | 应符合规定 |
| 可见异物 | 通则0904可见异物检查法 | 应符合规定 |
| 不溶性微粒 | 通则0903不溶性微粒检查法 | 应符合规定 |
| 纯度与杂质(1)分子排阻色谱法 | 高效液相色谱法(通则0512) | 供试品溶液2中贝伐珠单抗含量不得低于93%,供试品溶液1中聚体含量不得高于12% |
| 纯度与杂质(2)离子交换色谱法 | 高效液相色谱法(通则0512) | 贝伐珠单抗不得小于45.0%,酸性组分含量不得过42.0%,碱性组分含量不得过18.0% |
| 纯度与杂质(3)毛细管凝胶电泳法 | 单抗分子大小变异体测定法(通则3127 第一法) | 还原电泳限度贝伐珠单抗重链、非糖基化重链和轻链的修正峰面积不得小于总修正峰面积的94.0% |
| 非还原电泳限度贝伐珠单抗主峰修正峰面积不得小于总修正峰面积的90.0%,片段修正峰面积不得高于总修正峰面积的10.0% | ||
| 聚山梨酯80含量(如有) | 通则3203 第二法 聚山梨酯80残留量测定法 | 应符合规定 |
| 聚山梨酯20含量(如有) | 高效液相色谱法(通则0512) | 应符合规定 |
| 异常毒性 | 通则1141小鼠试验法 | 应符合规定 |
| 无菌 | 通则1101薄膜过滤法 | 应符合规定 |
| 细菌内毒素 | 动态显色法(通则1143) | 每1ml不得大于2 EU |
| 生物学活性 | 通则3541 贝伐珠单抗生物学活性测定法 | 供试品生物学活性应为标准品的70%~130% |
| 含量测定 | 蛋白质含量测定法(通则0731第六法) | 应为标示量的90%~110% |
表6 利妥昔单抗注射液质量标准
| 检测项目 | 检测方法 | 质量标准 |
|---|---|---|
| 外观 | 直接观察法 | 应为无色至淡黄色的澄清液体 |
| 鉴别(1) 肽图 | 肽图检查法(通则3405) | 供试品溶液的肽图谱应与对照品溶液的肽图谱一致 |
| 鉴别(2) 等电点 | 单抗电荷变异体测定法(通则3129)任选一法 | 供试品溶液图谱应与对照品溶液图谱一致, 主峰等电点与对照品主峰等电点差值应不大于0.2 |
| pH | 通则0631 pH值测定法 | 应符合规定 |
| 渗透压摩尔浓度 | 通则0632 渗透压摩尔浓度测定法 | 应符合规定 |
| 可见异物 | 通则0904 可见异物检查法 | 应符合规定 |
| 不溶性微粒 | 通则0903 第一法光阻法 | 应符合规定 |
| 装量 | 注射剂(通则0102) | 应符合规定 |
| 纯度与杂质(1)分子排阻色谱法 | 单抗分子大小变异体测定法(通则3127 第二法) | 利妥昔单抗含量应不低于95.0%,聚体含量应不大于5.0% |
| 纯度与杂质(2)离子交换色谱法 | 高效液相色谱法(通则0512) | 利妥昔单抗含量应不低于 55.0%,酸性组份含量应不大于32.0% |
| 纯度与杂质(3)非还原 毛细管凝胶电泳法 |
单抗分子大小变异体测定法(通则3127 第一法) | 利妥昔单抗主峰的修正峰面积应不小于总修正峰面积的90.0% |
| 纯度与杂质(4) 还原毛细管凝胶电泳法 | 单抗分子大小变异体测定法(通则3127 第一法) | 利妥昔单抗重链(HC)和轻链(LC)的修正峰面积之和应不小于总修正峰面积的95.0%,非糖基化重链的修正峰面积应不大于总修正峰面积的2.0% |
| 聚山梨酯 80 含量(如有) | 通则3203 第二法 聚山梨酯80残留量测定法 | 应符合规定 |
| 细菌内毒素 | 动态显色法(通则1143) | 每1mL 含内毒素的量应不高于1.0 EU |
| 无菌 | 通则1101 薄膜过滤法 | 应符合规定 |
| 异常毒性 | 通则1141 小鼠试验法 | 应符合规定 |
| 生物学活性 | 通则3542 利妥昔单抗生物学活性测定法 | 生物学活性应为标准品的80%~120% |
| 含量测定 | 蛋白质含量测定法(通则0731 第六法) | 应为标示量的92.0%~108.0% |
3. 人用重组单克隆抗体药物检测解决方案
岛津在重组单克隆抗体药物研发、生产、质控和临床试验阶段均有一系列的色谱、质谱、光谱等多机型分析手段,应对抗体药物的一系列分析需求,例如:分子量测定、序列分析、翻译后修饰分析、电荷异质性分析、杂质分析、细胞培养过程监控、药代动力学分析等。
1) 细胞培养分析方法包同时分析抗体细胞培养上清液和细胞内144种组分

三重四极杆质谱仪
LCMS-8060RX/8050RX/8045RX
• 出色的易用性--无需反复优化离子源参数,智能改善分析和工作流程
• 优秀的稳健性--兼具高灵敏度和稳健性,减少了由于污染引起的灵敏度下降
• 普适性参数设置--提升电离效率,提高低质量范围的灵敏度
2)抗体类药物分子量测定/序列分析/翻译后修饰分析(含二硫键和糖型分析) /DAR值分析

四极杆飞行时间液质联用仪
LCMS-9030/9050
• 可靠的质量准确度--追求日常使用便利性
• 超稳定快速谱图采集--长时间快速稳定检测,减少校正和维护
• 多功能扩展性--定性和定量兼备,媲美三重四极杆的高灵敏度
3)抗体类药物N端序列分析——Edman降解法

蛋白质测序仪
PPSQ-51A/53A
• 分析稳定性--基线稳定, 保留时间重现性好,高灵敏度检测
• 法规合规性--符合FDA 21 CFR Part 11要求的齐全功能
• 分析简便性--色谱图再处理,色谱图叠加,氨基酸序列自动推测
4)抗体类药物分子量测定/蛋白聚集体分析/蛋白辅料分析

台式线性MALDI-TOF质谱仪
MALDI-8020/8030
• 快速进样分析--卸载/加载样品进行分析 <3 分钟
• 检测结果直观--无需多电荷解卷积
• 质量范围宽--多肽、蛋白质、抗体分析
5)抗体类药物杂质分析/电荷变异体分析/分子大小变异体分析/药物抗体偶联比分析

生物惰性液相
Nexera XS/Lite inert
. 优异的灵敏度和回收率——消除因金属吸附造成的样品损失
. 出色的耐受性和分离度——轻松应对高盐浓度和极端pH流动相的挑战
. 更高的可靠性和重现性——避免金属管路对化合物的吸附
6)抗体类药物聚集体分析——激光衍射散射法

聚集体分析仪
Aggregates Sizer
. 宽泛粒径范围--定量评价亚可见粒子区域聚合体的浓度
. 高灵敏度--高分辨率、准确检测宽范围粒径分布
. 快速定量--实时监测聚合体的时间序列变化
4. 人用重组单克隆抗体药物检测应用案例
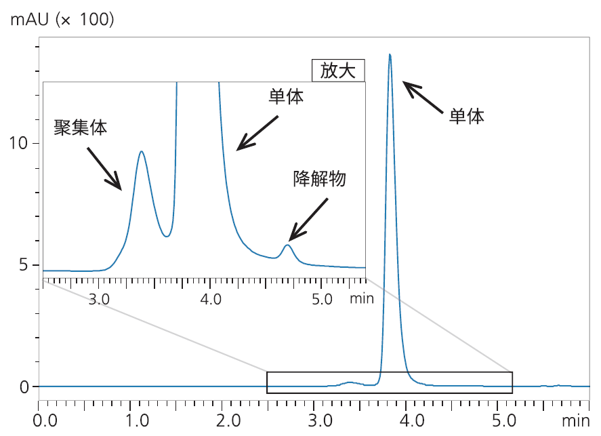
1) 使用分子排阻色谱法(SEC)分析mAb杂质
单克隆抗体(mAb)杂质(如聚集体和降解物)是影响药物疗效、不良反应、药物稳定性的重要因素,通常使用 SEC 对此进行评价。此次聚集体分析,使用了 mAb 标准品(市售),分析条件见表 7。在 mAb分析中,5分钟内完成了多聚体、单体及降解产物的色谱分离(图 1)。
| 表7 mAb杂质分析条件(图1) | |
 |
 |
| 图1 mAb聚集体分析的色谱图 |
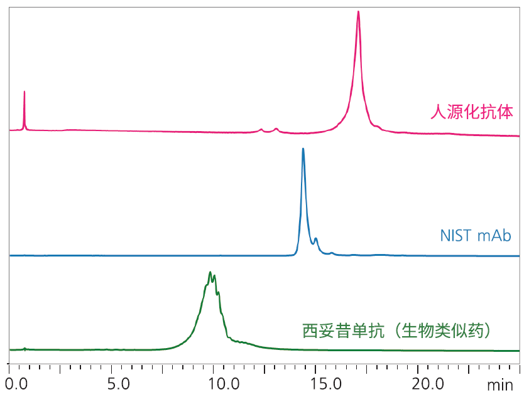
2) 使用离子交换色谱法(IEX)分析电荷异构体(电荷变异体)
由于单克隆抗体(mAb)结构复杂并具有不均匀性,因此该类药物中会存在电荷异构体与电荷变异体。电荷差异会对单抗药物稳定性和有效性产生影响,因此必须对电荷变异体进行准确评价。根据电荷强度的不同,IEX可用于分离mAb电荷变异体。按照表8所示的条件,本次实验对3种mAb进行了电荷变异体评估。在每个样品中,均成功检测到多种电荷变异体的多个色谱峰(图2)。
| 表8 mAb的电荷变异体分析条件(图2) | |
 |
 |
| 图2 3种mAb的色谱图 |
3) 在线二维液相色谱法分析单抗药物滴度和大小变异体
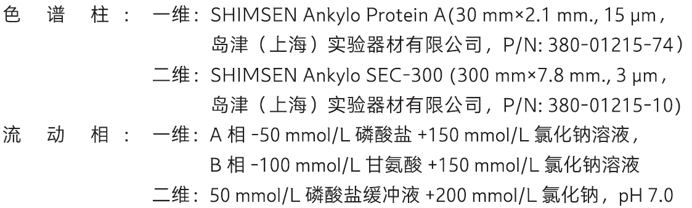
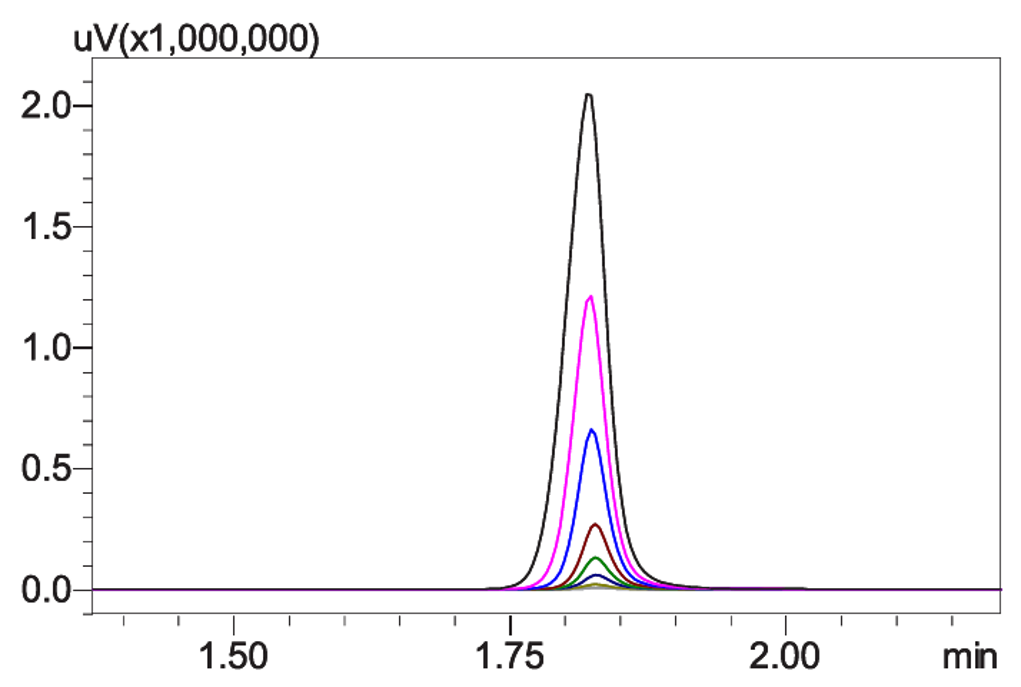
在单克隆抗体(单抗)药物的生产过程中,需测定细胞培养上清液中单抗的滴度或浓度,以选出高产量的单抗药物。此外,在药品的生产过程中还可能会产生聚集体和碎片,其与主产品具有不同的药效,有时会引起严重的副作用。本文介绍了一种采用在线二维液相色谱法(图3)测定单抗药物的滴度和大小变异体含量的方法,分析条件见表9。一维使用Protein A亲和色谱柱对单抗溶液进行分离(图4),通过阀切换将收集到定量环中的单抗组分转移到二维,利用SEC色谱柱分离样品中的大小变异体和单体(图5,表10),从而实现全自动在线二维液相分离单抗药物的目的。
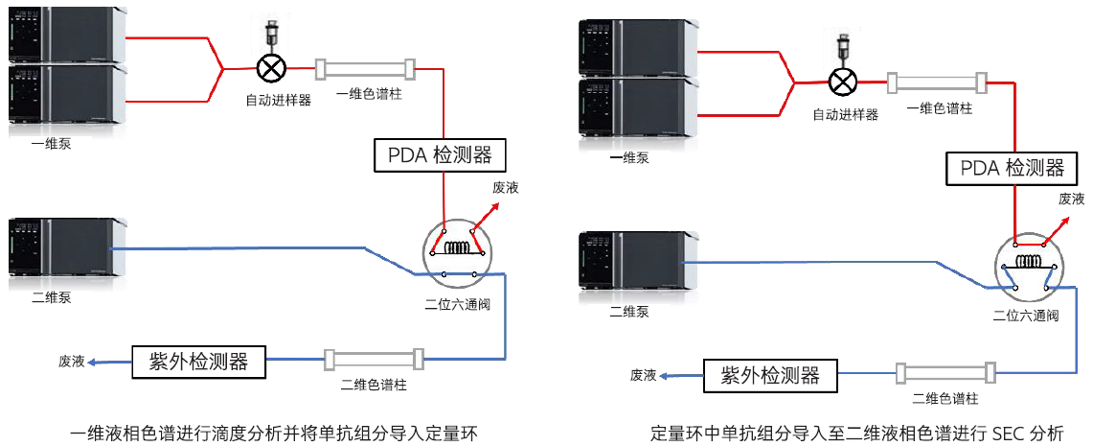
图3 二维液相色谱系统流路图
表9 分析条件
 |
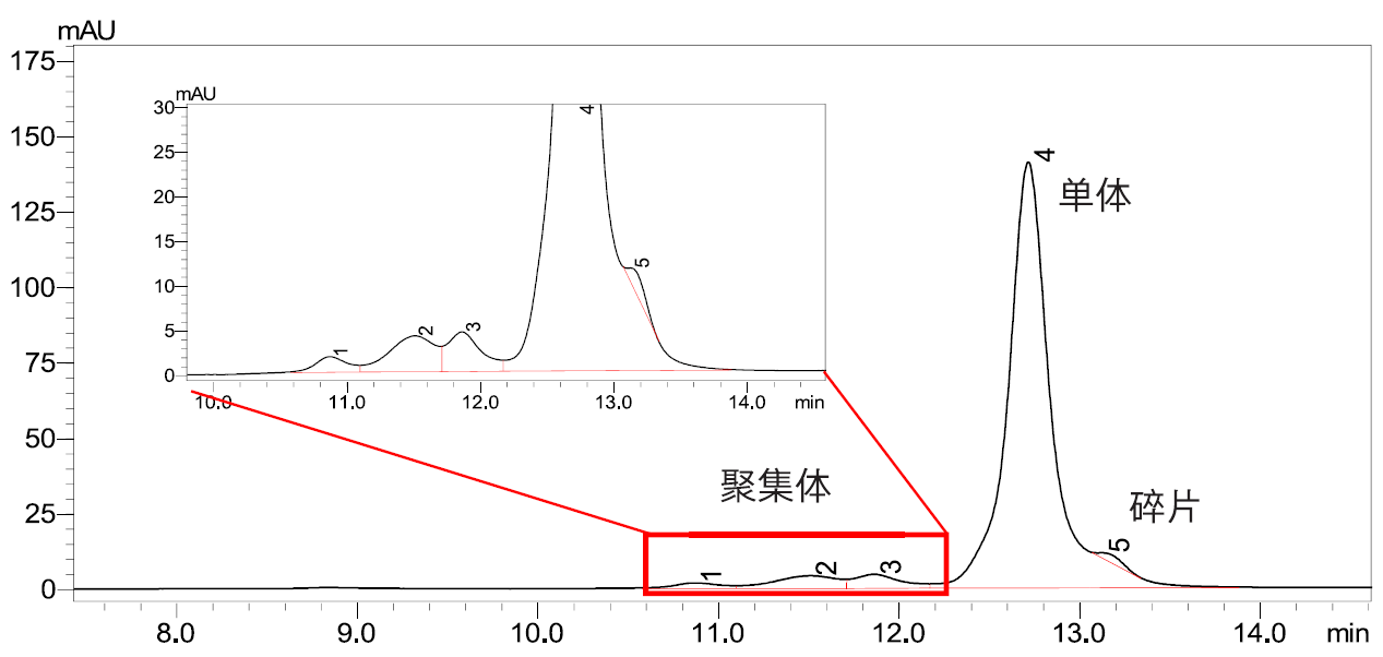 |
| 图4 标准溶液色谱图(浓度为 0.03~6mg/mL) | 图5 单抗样品大小变异体分析色谱图 |
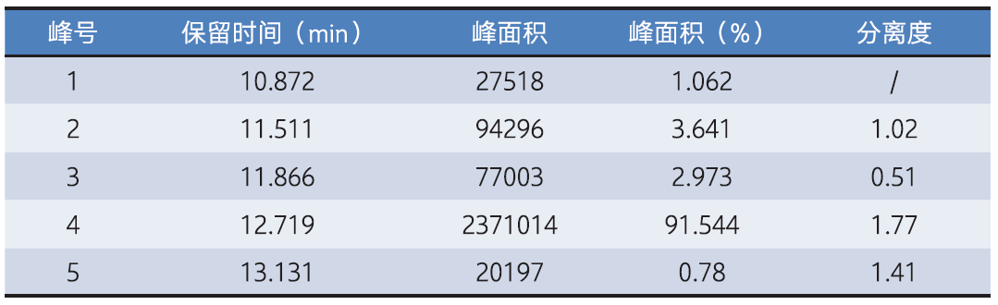
表10 单抗单体、聚集体和碎片峰面积及百分比
4) 超高效液相色谱测定蛋白类药物中的唾液酸含量
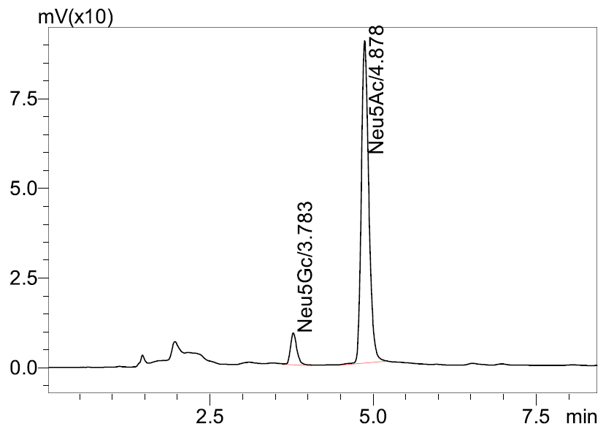
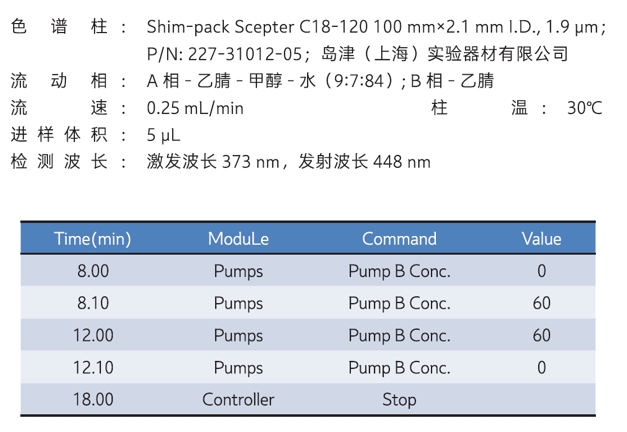
本文参考2025版药典"通则 3102 唾液酸测定法",建立了一种使用带荧光检测器的超高效液相色谱 Nexera LC-40X3 检测抗体药物中唾液酸含量的分析方法,分析条件见表11。样品经超滤脱盐,再经醋酸水解释放唾液酸,然后以 DMB 衍生标记后上机测定。方法线性范围宽(图6)、灵敏度高、重复性好、准确可靠(图7),可为抗体类药物中唾液酸含量测定提供参考。
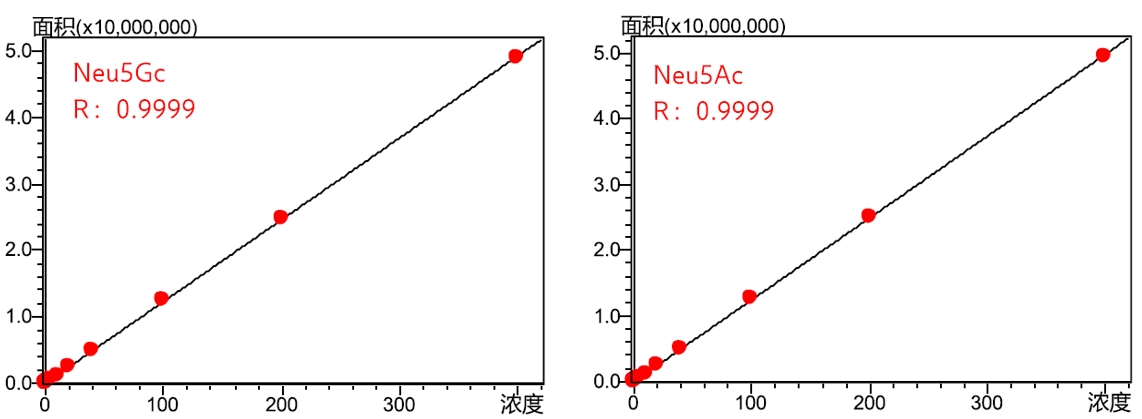
图6 Neu5Gc和Neu5Ac校准曲线图(浓度为0.02~400μmol/L)
| 表11 分析条件 | |
 |
 |
| 图7 单抗注射样品液唾液酸色谱图 |
岛津应用资料:
1. 利用LCMS-9030对NISTmAb进行整体蛋白分析
2. 利用LCMS-9030进行曲妥珠单抗药物肽图分析
3. 利用LCMS-9030进行英夫利昔单抗药物肽图分析
4. 采用LCMS-9030进行曲妥珠单抗药物二硫键分析
5. 利用岛津高效液相色谱与单四极杆质谱联用系统对曲妥珠单抗进行肽图分析
6. 应用蛋白质测序仪PPSQ-53A测定曲妥珠单抗的N-末端氨基酸序列
7. 利用超高效液相色谱仪连接荧光检测器和四极杆飞行时间质谱仪对曲妥珠单抗游离N糖进行分离与鉴定
8. 化学修饰抗体的简易质谱测定
9. 疏水作用色谱法(HIC)在抗体药物偶联物(ADC)药物抗体比值(DAR)和药物分布测定中的应用
10. 分子排阻色谱法测定单克隆抗体分子大小变异体的高效方法开发
11. 在线二维液相色谱法分析单抗药物滴度和大小变异体
12. 使用生物惰性超高效液相色谱仪分析抗体药物
13. 生物兼容液相在单抗样品电荷异质性分析中的应用
14. 使用FTIR光谱法测定单克隆抗体的蛋白质二级结构
15. 岛津高效液相色谱联合三重四极杆质谱测定抗体药物中2-脱氧-2-氟-岩藻糖的残留
16. 超高效液相色谱法用于抗体中唾液酸的测定
17. 超高效液相色谱三重四极杆质谱联用法用于抗体中唾液酸的测定
18. 利用电感耦合等离子体发射光谱仪测定单抗药物中消泡剂残留量
19. 顶空-气相色谱法分析药物中的有机溶剂残留
20. 使用生物惰性超高效液相色谱仪分析抗体药物
21. 生物兼容液相色谱仪与多角度光散射检测器联用测定曲妥珠单抗主成分及聚集体分子量
22. Nexera Bio液相色谱系统用于阿达木单抗的聚集体分析
23. 岛津生物兼容液相Nexera Bio联合蒸发光散射检测器测定抗体药物中吐温80的含量
24. 基于nSMOL技术和Skyline软件的曲妥珠单抗LC-MS/MS定量分析方法开发
25. 基于EreximTM技术对曲妥珠单抗的N-多糖微观异质性进行结构表征
26. 细胞培养上清液分析技术在抗体生产细胞培养工艺筛选中的应用
27. 利用ICPMS-2030监控细胞培养上清液中无机元素含量变化
28. 超高效液相色谱测定蛋白类药物中的唾液酸含量
以上资料,可前往岛津中国官网https://www.shimadzu.com.cn/搜索获取。



