解决方案-2025年版《中国药典》药用辅料标准主要增修订内容
自2015年版《中国药典》(第十版)起,药用辅料与通则(经药典附录整合而成)单独成卷作为药典四部。经10年发展,2025年版《中国药典》收载药用辅料总数已达387个。
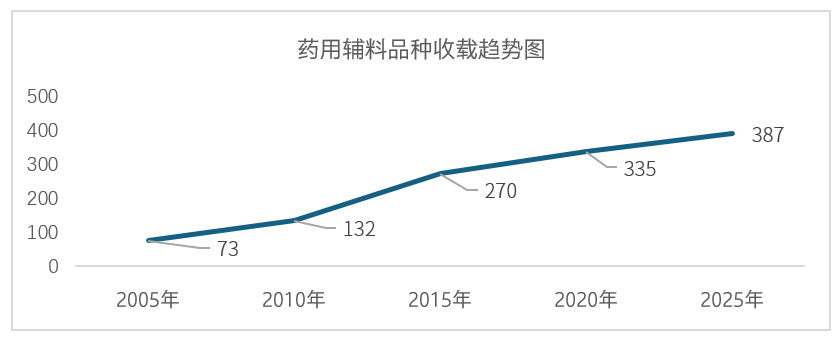
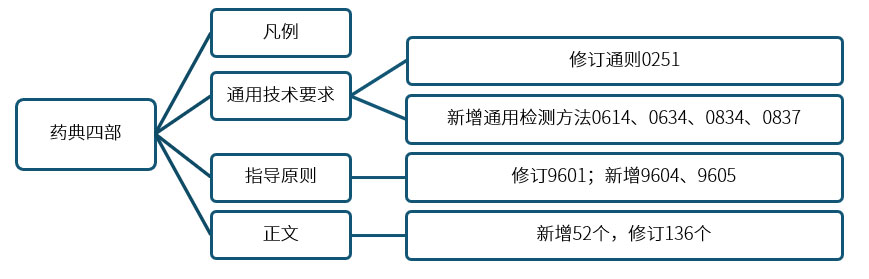
2025年版《中国药典》新增药用辅料品种标准52个,修订品种标准245个,其中仅文字修订的109个,有实质性修订的136个。
《中国药典》药用辅料标准制修订围绕加强完善药用辅料关键质量属性展开,特别是安全性指标和功能性相关指标,通过与药用辅料标准的国际协调、推行绿色环保药用辅料标准,提升检验效能和安全性,完善标准的规范性和可操作性,增强标准的兼容性和普适性,切实保障原辅包关联审批制度的落实,引导企业选择适合制剂生产的药用辅料。
本版四部凡例相关内容、通则0251药用辅料和9601药用辅料功能性相关指标指导原则均进行了重要修订。
四部凡例“辅料相关内容”修订情况
| 2020年版ChP | 2025年版ChP | 修订说明 |
|---|---|---|
| 品种正文,“九” 本部品种正文系根据药用辅料的特性,按照生产工艺、用途、贮藏运输条件等所制定的技术规定。 |
品种正文,“八” 药品品种正文系根据药物自身的理化与生物学特性,按照来源、处方、制法和运输、贮藏等条件所制定的、用以评估药品质量在有效期内是否达到药用要求,并衡量其质量是否均一稳定的技术要求。 本部药用辅料品种正文系根据药用辅料的特性,基于特定的生产工艺、用途、贮运条件等,所制定的技术要求。 |
完善修订 |
| 项目与要求,“第十五” 性状项下记载的外观、臭、溶解度以及物理常数等,在一定程度上反映药用辅料质量特性。 (1)(2)… |
项目与要求,“第十五” 性状项下记载的外观和物理常数等,在一定程度上反映药用辅料质量特性。 (1)(2)… (3)物理常数不仅具有鉴别意义,也可在一定程度上反映药用辅料纯度 |
新增(3) |
| 项目与要求,“第十七” 检查项下包括反映药用辅料理化性质、安全性和功能性相关指标等的检查;对于规定中的各种杂质检查项目,系指药用辅料在按既定工艺进行生产和正常贮藏过程中可能含有或产生并需要控制的杂质(如残留溶剂、有关物质等);改变生产工艺时需另考虑增修订有关项目。 对于生产过程中引入的有机溶剂,应在后续的生产环节予以有效去除。除正文已明确列有"残留溶剂"检查的品种必须对生产过程中引入的有机溶剂依法进行该项检查外,其他未在"残留溶剂"项下明确列出的有机溶剂或未在正文中列有此项检查的各品种,如生产过程中引入或产品中残留有机溶剂,均应按通则"残留溶剂测定法"检查,并应符合相应溶剂的限度规定。 |
项目与要求,“第十七” 检查项下包括反映药用辅料理化性质、安全性和功能性相关指标等的检查;其中杂质检查,系指药用辅料在按既定工艺进行生产和正常贮藏过程中可能含有或产生并需要控制的杂质。 |
删除对于残留溶剂相关要求,但此部分内容,在“通则0251药用辅料”中进行了详细补充(见0251修订内容) |
通则0251药用辅料修订情况
| 2020年版 | 2025年版 | 修订说明 |
|---|---|---|
| 药用辅料系指生产药品和调配处方时使用的赋形剂和附加剂;是除活性成分或前体以外,在安全性方面已进行了合理的评估,一般包含在药物制剂中的物质。 在作为非活性物质时,药用辅料除了赋形、充当载体、提高稳定性外,还具有增溶、助溶、调节释放等重要功能,是可能会影响到制剂的质量、安全性和有效性的重要成分。因此,应关注药用辅料本身的安全性,以及药物-辅料相互作用 | 药用辅料系指生产药品和调配处方时使用的赋形剂和附加剂;是除活性成分或前体以外,在安全性方面已进行了合理的评估,一般包含在药物制剂中的物质。 药用辅料除了赋形、充当载体、提高稳定性外,还具有增溶、助溶、调节释放等重要功能,是可能会影响到制剂的质量、安全性和有效性的重要成分。 | 本段是对药用辅料的基本定义,删除最后一句,相关内容移至“第三”相关内容 |
| 药用辅料可从来源、用途、剂型、给药途径进行分类。 按来源分类可分为天然物、半合成物和全合成物。 按用于制备的剂型分类可用于制备的药物制剂类型主要包括片剂、注射剂、胶囊剂、颗粒剂、眼用制剂、鼻用制剂、栓剂、丸剂、软膏剂、乳膏剂、吸人制剂、喷雾剂、气雾剂、凝胶剂、散剂、糖浆剂、搽剂、涂剂、涂膜剂、剂、贴剂、贴膏剂、口服溶液剂、口服混悬剂、口服乳剂:植人剂、膜剂、耳用制剂、冲洗剂、肠剂、合剂等。 按用途分类可分为溶剂、抛射剂、增溶剂、助溶剂乳化剂、着色剂、黏合剂、崩解剂、填充剂、润滑剂、润湿剂、渗透压调节剂、稳定剂(如蛋自稳定剂)、助流剂、抗结块剂、矫味剂、抑菌剂、助悬剂、包衣剂、成膜剂、芳香剂、增黏剂、抗黏着剂、抗氧剂、抗氧增效剂、螯合剂、皮肤渗透促进剂、空气置换剂、pH调节剂、吸附剂、增塑剂、表面活性剂、发泡剂、消泡剂、增稠剂、包合剂、保护剂(如冻干保护剂)、保湿剂、柔软剂、吸收剂、稀释剂、絮凝剂与反絮凝剂、助滤剂、冷凝剂、络合剂、释放调节剂:压敏胶黏剂、硬化剂、空心胶囊、基质(如栓剂基质和软膏基质)、载体材料(如干粉吸入载体)等。 按给药途径分类可分为口服、注射、黏膜、经皮或局部给药、经鼻或吸入给药和眼部给药等。 同一药用辅料可用于不同给药途径、不同剂型、不同用途。 |
药用辅料可从来源、所用剂型、功能、给药途径等进行分类。按来源分类,可分为天然物、半合成物和全合成物。按所用剂型分类,可参见制剂通则(通则0100)。按功能分类可参见药用辅料功能性相关指标指导原则(指导原则9601)按给药途径分类,可分为口服、注射、黏膜、经皮或局部给药、经鼻或吸入给药和眼部给药等。同一药用辅料可用于不同给药途径、不同剂型、不同用途。 | 完善修订,结合相关通则和指导原则进行说明 |
| 药用辅料的生产、使用等应符合下列规定 | 药用辅料的生产、使用和质量控制等应符合下列要求 | 补充“质量控制” |
| 一、生产药品所用的辅料必须符合药用要求,其生产应符合药用辅料生产相关质量管理规范等规定,其变更应符合有关法规和技术指导原则的要求进行研究和告知。 | 一、生产药品所用的辅料必须符合药用要求,其生产应符合现行版《药品生产质量管理规范》药用辅料附录等规定,其变更应符合有关法规和技术指导原则的要求。 | 按现行版法规执行,NMPA已发布了《药品生产质量管理规范(2010年修订)》药用辅料附录,2026年1月1日起执行 |
| 二、在特定的贮藏条件、有效期/复验期和使用途径下,药用辅料应化学性质稳定,不易受温湿度、pH值、光线、保存时间等的影响。 | 二、在特定的贮藏条件、期限和使用途径下,药用辅料应化学性质稳定,不易受温湿度、pH值、光线、保存时间等的影响。药用辅料的包装或标签上应标明产品名称及贮藏要求等信息。 | 文字修订和将原通则“六”中有关包装标签要求修订至此。原“六”删除 |
| 三、药品研究和生产中研究者及上市许可持有人选用药用辅料应保证该辅料能满足制剂安全性和有效性要求,并加强药用辅料的适用性研究。 适用性研究应充分考虑药用辅料的来源、工艺,及其制备制剂的特点、给药途径、使用人群和使用剂量等相关因素的影响。应选择功能性相关指标符合制剂要求的药用辅料,且尽可能用较小的用量发挥较大的作用。 |
三、药品研究和生产中研究者及上市许可持有人选用药用辅料应保证该辅料能满足药品安全性和有效性要求,并加强药用辅料的适用性研究。适用性研究应充分考虑药用辅料的来源、工艺,及其制备制剂的特点、给药途径、使用人群和使用剂量等相关因素的影响。应选择功能性相关指标符合制剂要求的药用辅料,且尽可能用较小的用量发挥较大的作用。应关注药用辅料本身的安全性,以及药物-辅料相互作用。 | 有内容修订完善 |
| 四、在制定药用辅料标准时既要考虑辅料自身的安全性,也要考虑制剂生产、质量、安全性和有效性的性质。药用辅料的标准主要包括两部分:与生产工艺及安全性有关的项目,如性状、鉴别、检查、含量测定等项目;影响制剂性能的功能性相关指标,如黏度、粒度等。药用辅料应满足所用制剂的要求,用于不同制剂时,需根据制剂要求进行相应的质量控制。 药用辅料的残留溶剂应符合要求;药用辅料的微生物限度应符合要求;用于无除菌工艺的无菌制剂的药用辅料应符合无菌要求(通则1101);用于静脉用注射剂、冲洗剂等的药用辅料照细菌内毒素检查法(通则1143)或热原检查法(通则1142)检查,应符合规定。 |
四、药用辅料应满足所用制剂的要求,并根据制剂要求进行相应的质量控制。在制定药用辅料标准时既要考虑辅料自身的安全性,也要考虑影响制剂生产、质量、安全性和有效性的性质。药用辅料的标准主要包括两部分:与生产工艺及安全性有关的项目;影响制剂性能的功能性相关指标。根据药用辅料特性或使用风险程度,分别以性状、鉴别、检查、含量测定、标示、注等项目列入药用辅料标准。 | 修订。 对安全性要求分“五”和“六”进行详细阐述 |
| / | 五、药用辅料残留溶剂和元素杂质的控制应参照相关通则(通则0861和通则0862)和ICH的要求,根据药用辅料的生产工艺和拟应用的制剂需要进行风险评估和相应控制,以确保药用辅料的质量、安全及功能满足制剂的需要…(详见颁布版) | 新增。 对安全性提出具体要求,为主要修订内容。新增企业对药用辅料残留溶剂、元素杂质控制的总原则 |
| / | 六、药用辅料是药品生产过程中微生物污染的主要来源之一,应基于风险管理与过程管理理念,充分识别药用辅料产生微生物污染的风险,并有针对性地进行风险评估和控制…(详见颁布版) 对药用辅料进行细菌内毒素(或热原)检查,目的是为了保证采用该药用辅料生产的药品的细菌内毒素(或热原)检查符合规定…(详见颁布版) 不论《中国药典》药用辅料品种正文中设置微生物限度、无菌、细菌内毒素(或热原)项目与否,药用辅料均应符合所关联制剂的要求。 |
新增。 对安全性提出具体要求,为主要修订内容。新增对微生物、细菌内毒素(或热原)控制的总原则 |
| 五、本版药典收载的药用辅料标准是对其质量控制的基本标准对于声称符合《中国药典》的药用辅料必须执行应当符合《中国药典》的相应标准。 如经研究确认《中国药典》收载的药用辅料标准不能 全部适用于某一制剂的安全性、有效性及制剂的需求,或《中国药典》尚未收载某药用辅料品种或规格,在药品制剂研发和上市后变更研究中可选择适宜的药用辅料,并制定相应的内控标准。 在充分评估的基础上,《中国药典》收载的药用辅料标准应根据已上市药品中使用的药用辅料的质量特点,适时进行修订。 |
七、本版药典收载的药用辅料品种正文系根据药用辅料的特性,基于特定的生产工艺、用途、贮运条件等,所制定的技术规定,其项目与要求等见本部凡例。对于声称符合《中国药典》的药用辅料必须符合《中国药典》的相应标准。如本部药典收载的药用辅料标准不能满足某一制剂的需求,或本部药典尚未收载某一药用辅料标准,在制剂研发和上市后变更研究中可选择适宜的药用辅料,并制定相应的标准。 | 进行了整体修订 |
| 六、药用辅料的包装或标签上应标明产品名称、规格(型号)及贮藏要求等信息。 能表明是药用辅料的字样、本部品种正文标示项下规 定应标明的内容,应在产品标签、包装、质量标准或检验报告书(其中至少一个)中标明。 仅在标示项中涉及的功能性相关指标,其检测方法及 限度要求应由药用辅料供需方在随行检验报告书或质量协议等载体中载明。 |
/ | 删除 |
9601药用辅料功能性相关指标指导原则修订情况
药用辅料作为药物制剂重要组成部分,在保证药物制剂生产和使用物质基础的同时,更决定药物制剂的性能及其安全性、有效性和稳定性。制剂中使用的药用辅料一般具有特定的功能性,药用辅料功能性相关指标(FRCs)是对辅料功能性和制剂性能具有重要影响的理化性质,同一种药用辅料在不同类型的制剂中其FRCs的确定及其范围控制可能存在差异,所以,药用辅料FRCs是药物制剂处方和工艺筛选的质量源于设计(Quality by Design,QbD)的基础。
2015年版《中国药典》首次收载药用辅料功能相关指标研究指导原则,并在2020年版进行修订,2025年版药用辅料功能相关指标的研究内容进一步扩充和完善,主要修订变化如下,供参考:
| 指导原则内容 | 2020年版ChP | 2025年版ChP | 变化说明 |
|---|---|---|---|
| 体例 | 概述-化学性质-物理性质-功能机制-功能性相关指标 | 概述-理化性质-功能机制-功能性相关指标 | 提高可读性 |
| 原类别拆分 | 包衣剂或增塑剂 | 包衣剂、增塑剂(新) | 内容更加清晰,便于理解 |
| 类别数量 | 19项 | 25项 | 新增:增塑剂、增溶剂、抑菌剂、渗透压调节剂、经皮渗透促进剂、冷冻剂 |
| 功能性相关指标及检查法修订 | / | 崩解剂、包衣剂、表面活性剂、栓剂基质、软膏基质 | 新增5个类别(见下表),重点补充了崩解剂的“崩解机制”描述 |
品种增修订概况
药用辅料标准新增52个,包括《中国药典》2020年版第一增补本收载的11个品种,与2020年版相比增长15.5%。新增品种中包含中药、化药、生物制品的多种剂型所用的常用及特殊药用辅料,标准更加凸显药用辅料的关键质量属性,从名称到每个项目更加规范严谨。
本版修订品种标准245个,其中仅文字修订的109个,有实质性修订的136个,具体涉及加强标准的规范性、增加功能性相关指标、增加安全性指标(含自身安全性和辅料对制剂安全性影响)、增强标准的普适性、与国际标准协调和药典转化实施以及突出绿色环保标准理念这六大方面。
参考文献:
【1】陈蕾,陈英,刘雁鸣,等.《中国药典》2020年版第一增补本药用辅料标准解读[J]. 中国药品标准,2024,25(2):168-175
【2】陈蕾,刘雁鸣,袁耀佐,等.2025年版《中国药典》药用辅料修订品种标准概况[J]. 中国药品标准,2025,26(1):51-57
【3】陈蕾,陈英,涂家生,等. 2025年版《中国药典》药用辅料新增品种标准解读[J]. 中国药品标准,2025,26(1):58-66
2025年版《中国药典》药用辅料综合解决方案
● 符合药典法规要求
● 简便易用
● 性能优异
1、分析仪器

2、消耗品方案

如需获取样本,请联系岛津

扫描以下二维码,在线阅读药用辅料应用方案
(请见附件1)




