解决方案-蛋白质组学分析方法及应用(增订9024)
1.蛋白质组学分析方法及应用指导原则简介
蛋白质组(Proteome) 是一个细胞或组织中由基因组表达的全部蛋白质。蛋白质组学(Proteomics) 表示对整个蛋白质组的研究,是一门大规模、高通量、系统化的研究某一类型细胞组织、某一基因组所表达的所有蛋白质,包括组成蛋白质一级结构的氨基酸序列,蛋白质的丰度,蛋白质的修饰以及蛋白质之间的相互作用的学科。随着人类基因组测序的完成,发现基因组学信息并不能完整地阐释复杂疾病的发生与发展,蛋白质组学、转录组学和代谢组学等蓬勃兴起。蛋白质是生命活动的最终执行者,在生命及疾病发生发展过程中的意义重大,因此蛋白质组学作为其中最重要的研究领域之一受到关注。
1.1适用范围
本指导原则适用于蛋白质组学在蛋白质组成及其变化规律、蛋白质翻译后修饰以及蛋白质与蛋白质之间相互作用方面的分析研究,规范蛋白质组学分析方法的建立、分析过程的质量控制和数据分析,确保蛋白质组学分析结果的重复性与可靠性。
1.2蛋白质组学的分析策略
1)自下而上( Bottom up)- 肽水平蛋白质组学
酶切:采用各种蛋白酶切为肽段
分离:各种分离技术对肽段混合物进行分离
检测:质谱分析技术得到肽指纹图谱
分析:蛋白数据库及相关软件分析得到蛋白的定性和相对定量结果
2)自上而下( Top down)- 完整蛋白质组学
直接对整个蛋白质进行分析和鉴定
3)自中而下( Middle down )- 亚基水平蛋白质组学
使用适宜的蛋白酶例如木瓜蛋白酶(Papain )等将蛋白切为分子量约为 25-50 kDa 的亚基片段,进行分离与分析
1.3 蛋白质组学分析方法
1)蛋白样品的提取, 变性还原,酶解与多肽分离富集
凝胶电泳技术:二维凝胶电泳( 2D PAGE )、等电聚焦( IEF )技术等
色谱技术:反相色谱、离子交换色谱、分子排阻色谱、亲和色谱和多维液相色谱等
2)蛋白质分析与鉴定
质谱技术(Bottom up、 Top down、Middle down ):蛋白质的分子量、序列、翻译后修饰等相关信息
二维凝胶电泳技术:第一维电泳按照分子量分离,第二维将第一维按照分子量分离的蛋白依据等电点进一步分离
X射线技术:蛋白质的三维结构
核磁共振技术:蛋白质的二维或三维结构信息,可以研究蛋白质的构象动力学和相互作用
透射电子显微镜技术:蛋白质的三维结构,解析大分子复合物、蛋白质结构和相互作用
3)数据分析搜库工具
蛋白序列数据库:通常是FASTA格式,从公共数据库下载,如果是未知的蛋白,可以从DNA测序的序列翻译成蛋白;最常用的数据库Uniprot。
特异性酶解:在搜库时要明确使用的蛋白酶,比如最常用的胰蛋白酶(软件会自动识别它在K或R后面切断肽段)。如果我们不对酶切位点进行限制,计算机只好把所有的可能都穷尽一遍,产生非常多可能的肽段,不仅运行时间会非常长,而且错误匹配的可能性也会高很多。
转录后修饰:分两类,一种叫固定修饰,即在某种氨基酸残基上一定出现的特定基团修饰,比如加入乙酰化试剂进行乙酰化修饰;另一种叫可变修饰(动态修饰),就是说某一种氨基酸残基可能会被某种基因修饰(被修饰的可能性比较大),例如甲硫氨酸的氧化等。
碎片类型:CID或HCD碎裂产生by离子,搜索引擎就只按by离子的规则切割;没特别的原因,不建议大家再加入其它离子类型,不然会大大延长搜库时间,还会引入错误;如果是ETD碎裂则会产生cz离子,而QTOF会产生ax离子。搜库软件通常会根据我们指定的仪器类型来自动判断碎片离子的类型。
选择合适的搜库软件:可使用MASCOT、PROTEIN METRICS、PEAKS Studio等。
1.4 蛋白质组学分析的质量控制
1)QC 样品的类型
简单的肽混合物( QC1):单一蛋白质酶解产物,如牛血清白蛋白(BSA)
复杂的 QC 样本( QC2):全细胞裂解物如酵母裂解物、 HeLa 细胞裂解物
合成的肽混合物( QC3):人工修饰或同位素标记的方法合成肽混合物
2)QC 的评价指标与标准
鉴定的多肽和蛋白质,肽段谱匹配( PSMs )数量,二级谱图的数量
肽段的平均丰度(基于母离子的离子信号强度)
所鉴定的肽段中 m/z 与理论值差距在 ±0.003 Da 内的肽段的比例
最大进样时间内所获得的二级谱图的比例
选定的示踪肽段保留时间
表1 QC评价指标
| 评价内容 | QC评价指标内容 | 描述 |
|---|---|---|
| 样本处理 | 酶切漏切比例 | 酶切位点漏切比例 |
| 酶切位点特异性 | 位点特异性酶切所占比例 | |
| 色谱分析 | tR | 保留时间、相对保留时间 |
| 峰宽和半峰宽 | 采集的色谱峰的峰宽和半峰宽 | |
| 质谱分析 | TIC图 | 采集的总离子流图 |
| MS/MS谱图 | 采集和鉴定的MS/MS谱图数目 | |
| % ITmax | 在设定的最大进样时间获得的MS/MS谱图的百分比 | |
| 鉴定与定量 | 蛋白质数目 | 鉴定的蛋白质数目 |
| 肽段数目 | 鉴定的肽段数目 | |
| 肽段谱匹配数目 | 与肽段匹配的谱图数目 | |
| 肽段的平均丰度 | 所有总结的肽段丰度的平均值 | |
| % m/z | 肽段的m/z误差[△(m/z)]在士0.003Da之间的比例 |
注:使用的检测仪器不同,精密度有差异,可酌情调整。
3)QC 的数据处理
多肽的母离子和碎片信息搜索误差:母离子10ppm、子离子0.02Da,或两个均20ppm
多肽长度( Peptide Length):通常在4~40 个氨基酸残基,漏切最大位点数目为 2
错误发现率( False Discovery Rate FDR):常见的 FDR 阈值是 1%(PSM、肽以及蛋白质水平)
肽段谱图匹配( peptide spectrum matches PSM):PSM 至少为 1
特征肽段( Unique peptide):定性的特征肽段检测到的越多可信度越高,单个肽段进行鉴定的蛋白需要额外进行标注
蛋白质覆盖率( Protein Coverage):70%及以上的覆盖率
4)重复实验及其评价标准
生物学重复(必须进行):(主要用于评估不同生物样本之间的一致性和重复性)至少3次,简单样本5次,复杂样本(人血液/组织)建议每组30个以上样本10次重复
技术重复(尚无明确要求):主要用于评估同一生物样本在同一实验条件下的一致性和可重复性,样品量足够的情况下建议至少3次
评价标准
相关性分析:皮尔逊(Pearson) 相关系数-通常要求在 0.8 以上;
斯皮尔曼( Spearman )相关系数-通常要求在 0.7 以上
主成分分析(PCA ):方差贡献通常要求达到 70% 85% 或以上
重复检测率或测量误差分析:百分比变异系数( coefficient of variation, CV)
通常要求小于 20%
1.5 蛋白质组学的应用
未知蛋白质鉴定、蛋白质结构的解析、靶向蛋白质定量、以及生物技术药物研发、质量控制和体内药代动力学研究方面应用越来越广泛。
蛋白质组学分析技术目前通常基于质谱分析和生物信息学原理的高通量分析方法,快速、高效地检测、鉴定和定量蛋白质样品中的成分、数量和相互作用等基本信息,进而揭示蛋白质在生命体内的功能和调节等生物学特性。
重组蛋白类药物分析中的应用:分子量测定、氨基酸序列、肽谱、二硫键、翻译后修饰( N/O 糖基化位点、糖型)、杂质(截短体、突变体、异构体、聚集体、宿主细胞残留蛋白)等的分析与鉴定。
2.蛋白质组学分析解决方案
在蛋白质组学和生物制药领域,岛津公司提供了一系列先进的色谱、质谱和光谱等分析技术,全面覆盖蛋白质鉴定、结构解析、定量分析、药物研发及质控等关键需求。尤其在重组蛋白类药物的研发和质量控制中,岛津的分析平台能够高效完成分子量测定、结构表征、翻译后修饰以及杂质分析等关键任务,为生物制药企业提供可靠的技术支持。
1)分子量测定/序列分析/翻译后修饰分析(含二硫键和糖型分析)

四极杆飞行时间液质联用仪
LCMS-9030/9050
• 可靠的质量准确度--追求日常使用便利性
• 超稳定快速谱图采集--长时间快速稳定检测,减少校正和维护
• 多功能扩展性--定性和定量兼备,媲美三重四极杆的高灵敏度
2)分子量测定/翻译后修饰分析

台式线性MALDI-TOF质谱仪
MALDI-8020/8030
• 快速进样分析--卸载/加载样品进行分析 <3 分钟
• 检测结果直观--无需多电荷解卷积
• 质量范围宽--多肽、蛋白质、抗体分析
3)肽段含量测定/翻译后修饰程度分析

三重四极杆质谱仪
LCMS-8060RX/8050RX/8045RX
• 出色的易用性--无需反复优化离子源参数,智能改善分析和工作流程
• 优秀的稳健性--兼具高灵敏度和稳健性,减少了由于污染引起的灵敏度下降
• 普适性参数设置--提升电离效率,提高低质量范围的灵敏度
3. 蛋白质组学分析应用案例
1) 自下而上( Bottom up)- 肽水平蛋白质组学
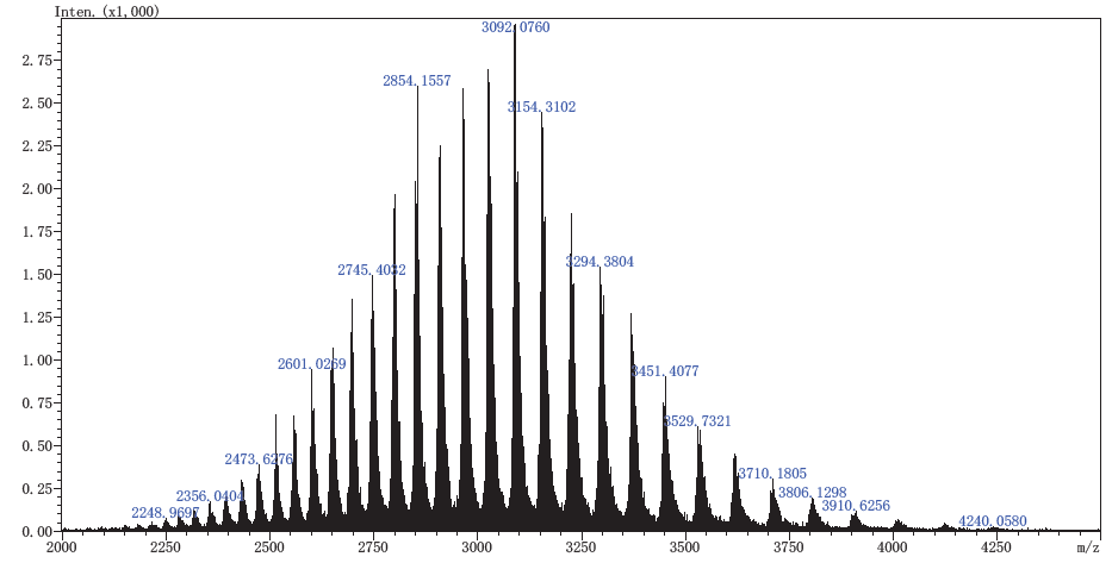
采用岛津LCMS-9030 高分辨液质联用仪对英夫利昔单抗样品进行肽图分析,并结合LabSolutions 和Protein Metrics(PMi 公司)软件对肽图分析结果进行解析。结果显示在只应用胰蛋白酶的情况下,轻链和重链的序列覆盖率分别为93.46% 和92.00%。经Protein metrics 软件对肽段上的修饰基团进行解析,结果显示该单抗样品上的修饰类型有脱酰胺(deamidated)、糖基化(NGlycan)、氧化(Oxidation)、氨甲酰化(Carbamyl) 等,大部分修饰类型所占比例在0.5% 以下(图 1)。
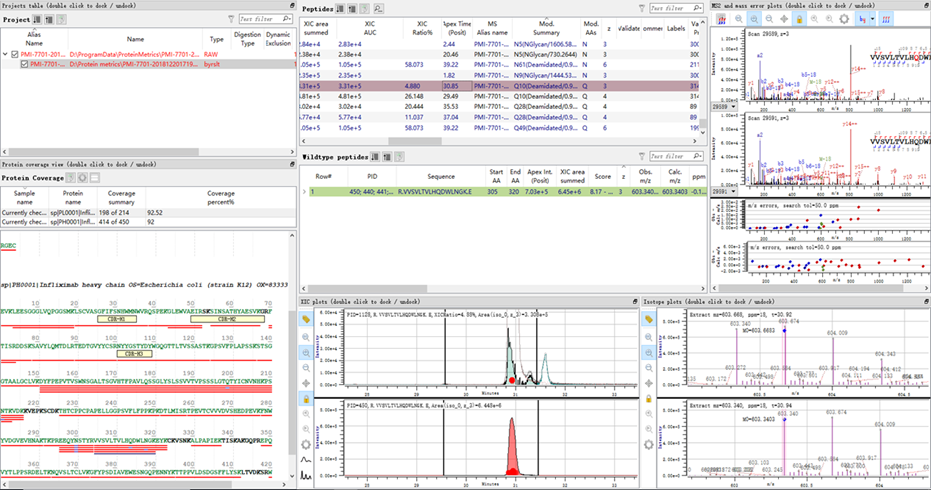
图1 英夫利昔单抗酶解后肽图蛋白分析
2) 自上而下( Top down)- 完整蛋白质组学
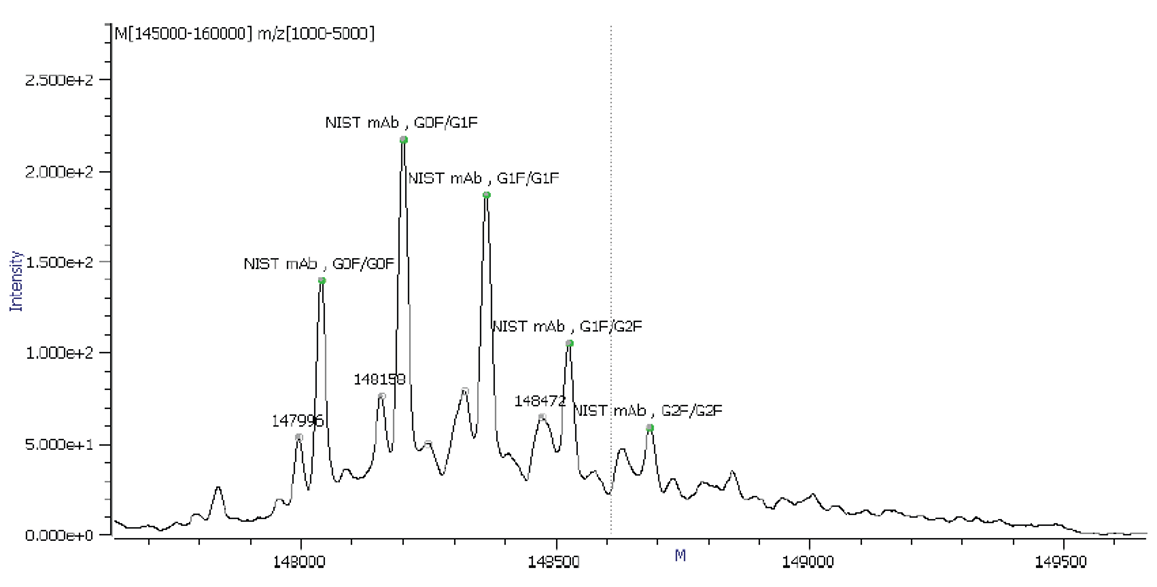
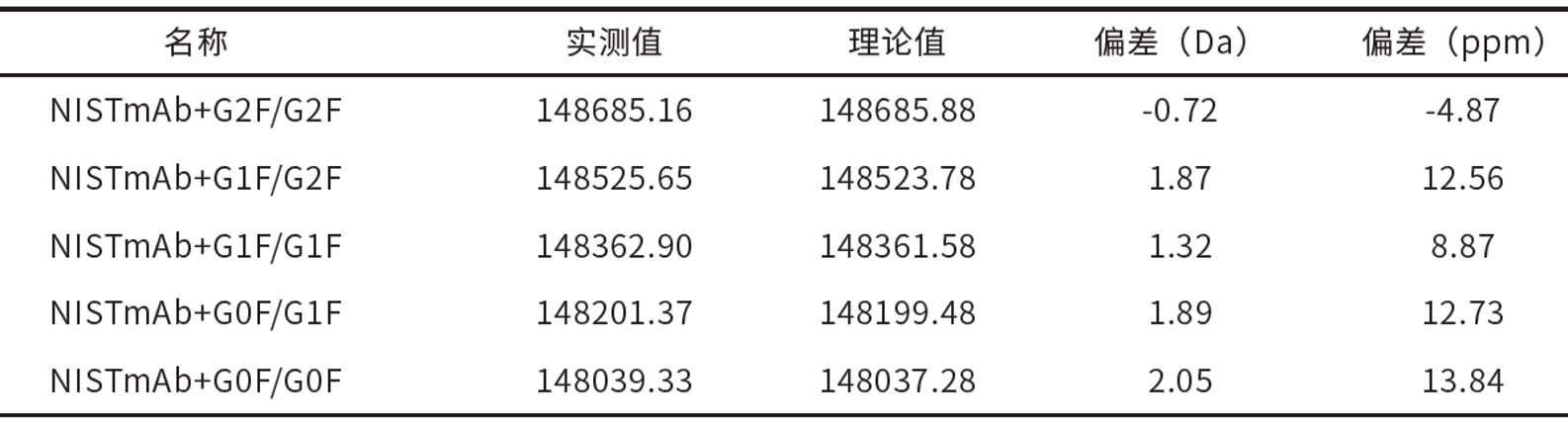
采用岛津LCMS-9030 高分辨液质联用仪对重组人源化单抗IgG1κ NISTmAb 进行整体蛋白分析(图 2),并结合岛津LabSolutions 和Protein Metrics(PMi 公司)软件对多电荷分析结果进行解卷积和修饰基团确认(图 3)。结果显示该重组人单抗含有不同的糖基修饰,包含G2F/G2F,G1F/G2F,G1F/G1F,G0F/G0F, G0F/G1F,和理论值的偏差均小于3Da(表 2)。
|
图2 NISTmAb 质谱图 |
图3 NISTmAb 解卷积后的谱图 |
表2 软件自动识别的不同修饰的NIST mAb结构
3) 自下而上( Bottom up)- 多肽药物结构表征
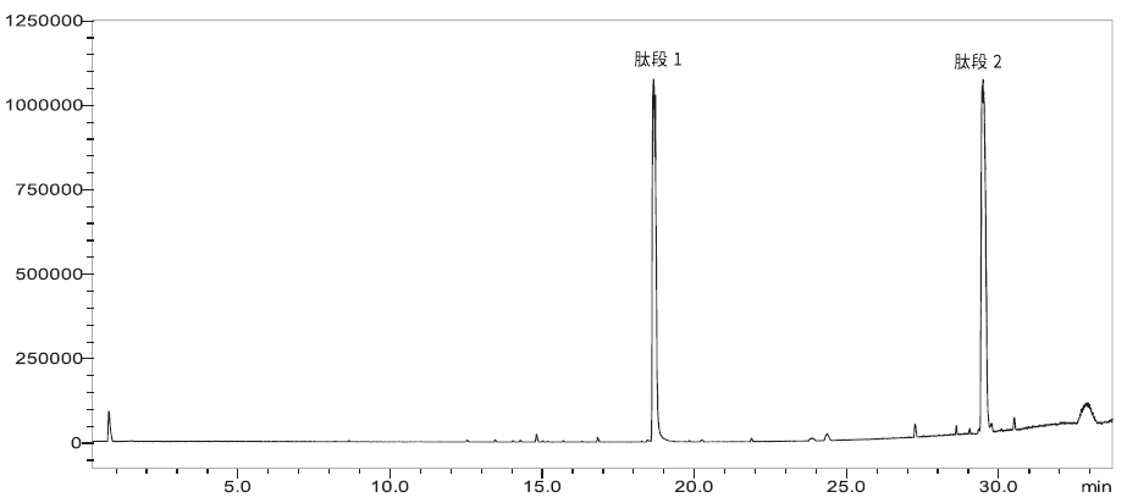
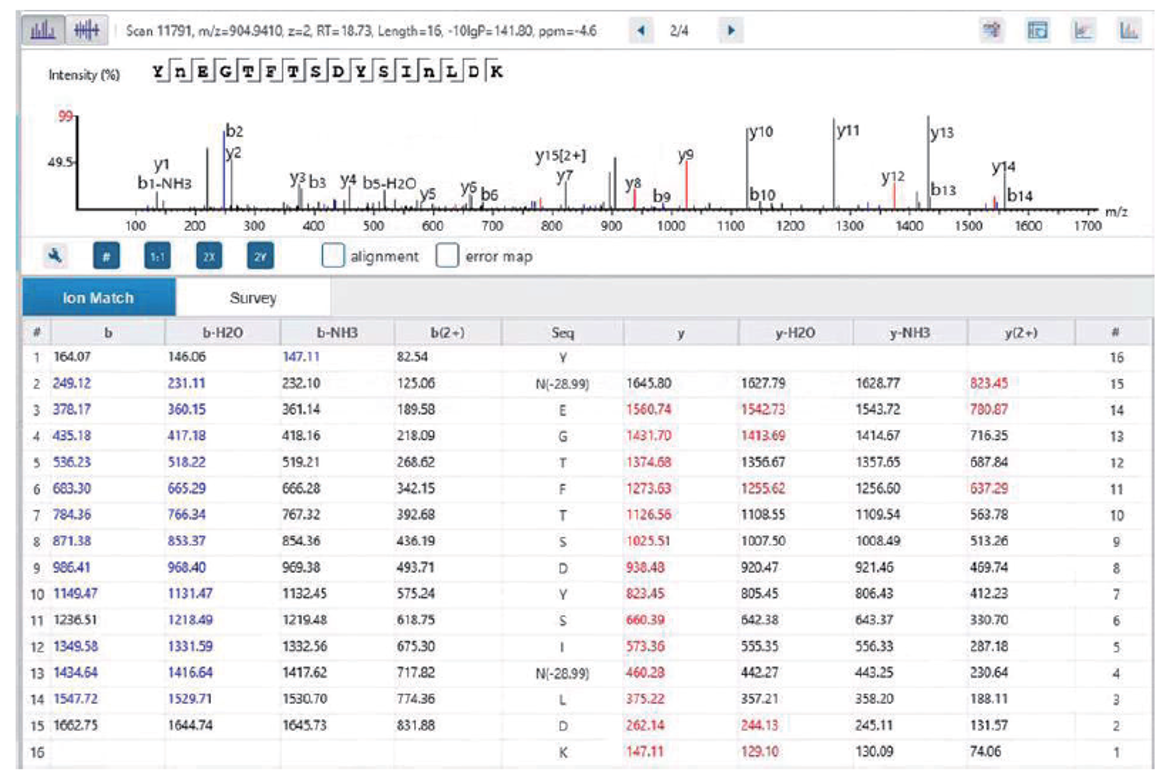
采用岛津LCMS-9050高分辨液质联用仪对替尔泊肽酶切后样品进行数据采集(图 4),并结合PEAKS软件对采集结果解析,对替尔泊肽的结构进行了确认(图5)。结果显示,使用Lys-C酶切能够实现100%的序列覆盖度,并且推测出序列中氨基酸的修饰位点(图 6)。该结果可为多肽药物的结构确证提供方法参考。
|
图4 替尔泊肽酶解后的总离子流色谱图 |
图5 肽段1二级质谱图及氨基酸碎片归属 |
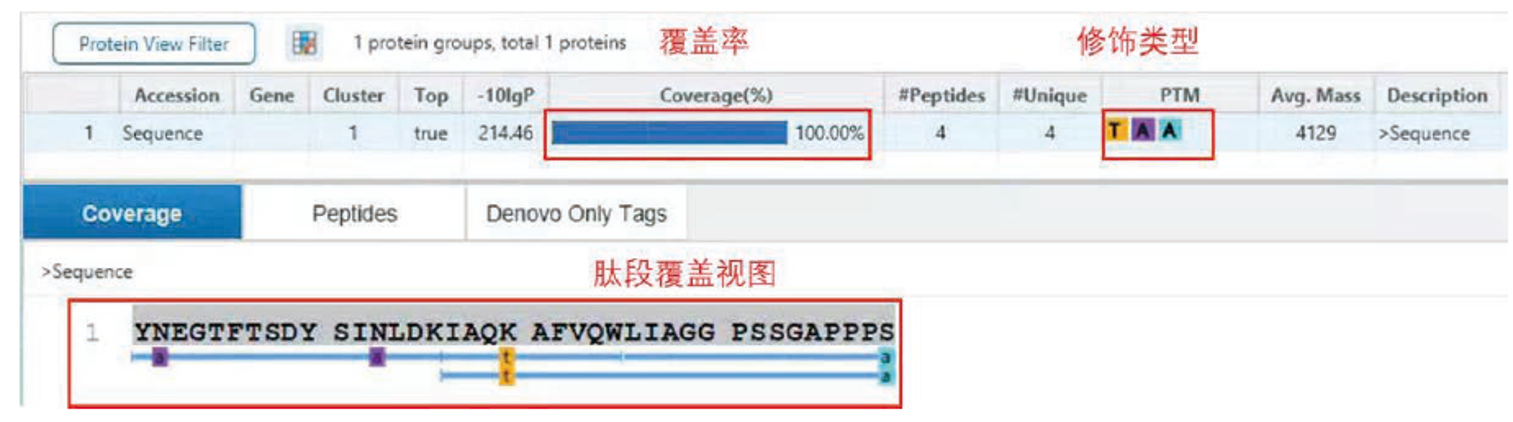
图6 替尔泊肽序列覆盖结果
岛津应用资料:
1. 利用LCMS-9030对NISTmAb进行整体蛋白分析
2. 利用高分辨液质联用仪进行替尔泊肽结构确认
3. 利用LCMS-9030进行曲妥珠单抗药物肽图分析
4. 利用LCMS-9030进行英夫利昔单抗药物肽图分析
5. 采用LCMS-9030进行曲妥珠单抗药物二硫键分析
6. 利用岛津高效液相色谱与单四极杆质谱联用系统对曲妥珠单抗进行肽图分析
7. 利用超高效液相色谱仪连接荧光检测器和四极杆飞行时间质谱仪对曲妥珠单抗游离N糖进行分离与鉴定
8. 超高效液相色谱法用于抗体中唾液酸的测定
9. 超高效液相色谱三重四极杆质谱联用法用于抗体中唾液酸的测定
以上资料,可前往岛津中国官网https://www.shimadzu.com.cn/搜索获取。