解决方案-人用疫苗杂质控制(增订9403)及新型疫苗(增订各论)分析
1.人用疫苗杂质控制技术指导原则简介
疫苗接种每年可拯救数百万人的生命,其通过与身体的天然防御系统协同作用来建立保护网,从而降低感染疾病的风险。据统计迄今拥有的疫苗可以预防20多种危及生命的疾病,帮助所有年龄段的人活得更长、更健康。目前,疫苗接种每年可防止350万至500万人死于白喉、破伤风、百日咳、流感和麻疹等疾病。疫苗接种是初级卫生保健的一个关键组成部分,也是一项无可争议的人权。它也是钱能买到的最好的健康投资之一。疫苗对预防和控制传染病暴发至关重要,疫苗支撑着全球卫生安全,并将成为抗击抗微生物药物耐药性斗争的重要工具(摘自WHO官网)。
然而直到今天,全球疫苗安全事件仍层出不穷。不规范的管理、不合法的添加、不合规的质量控制都是疫苗安全事件频发的原因,进而导致疫苗这一本用于预防/治疗疾病的工具却成为了加速疾病和死亡的利器。在疫苗的质量控制中,杂质的分析和控制至关重要。
疫苗杂质是指疫苗产品中的非目标成分,通常包括工艺相关杂质和产品相关物质/杂质。工艺相关杂质包括来源于细胞基质、培养基成分、靶标合成以及灭活和提取、纯化等工艺过程中使用的生物、化学材料残留物等;产品相关物质/杂质包括与生产用菌毒种、抗原表达系统相关的除疫苗有效抗原成分以外的其他成分以及抗原成分的聚合或降解产物等。
本指导原则是对人用疫苗产品杂质控制的基本考虑,旨在指导疫苗生产和研发过程中对杂质成分的分析、评估并制定相应的控制策略,以尽可能减少或消除杂质对疫苗安全性和有效性的影响,保证疫苗产品质量,应基于具体疫苗品种的特点及相关知识参考使用。
1)疫苗杂质来源
阐述了工艺相关杂质和产品相关杂质两大疫苗杂质来源,并提到要重点关注宿主细
胞蛋白和核酸、所用生物/化学材料的残留物以及包材相容性研究。
2)疫苗杂质控制的原则及策略
疫苗杂质控制应基于"质量源于设计"的原则,对疫苗中杂质进行风险评估、全过程控制和全生命周期管理,并列举了不同类型疫苗杂质的控制要点(表 1)。同时在文中提到有机溶剂的使用应符合"残留溶剂测定法"(通则0861)以及参照"分析方法验证指导原则"(指导原则9101)对检测方法进行验证,并重点关注方法的专属性和灵敏度。
注:以下内容根据2025年版《中国药典》说明整理。
表1 不同类型疫苗杂质的控制要点

√ 宿主细胞蛋白(USP1132/.1 免疫分析法/LCMSMS)
√ 核酸残留物(3407 探针杂交/荧光染色/定量PCR)
√ 宿主细胞DNA残留(3407/USP 杂交探针/荧光染色/定量PCR)
√ 核酸酶残留(3603 LC/UV,电泳)
√ 灭活/裂解剂(UC、LC、LCMSMS、GC、GCMS)、抗生素(3408 微生物法/酶联免疫法)、牛血清(3411 酶联免疫吸附法)等残留物

√ 有机溶剂等残留杂质(0861 GC,GCMS/GCMSMS)
√ 消泡剂、诱导剂等(LC、LCMSMS)
√ 核酸酶(3603 LC/UV,电泳)、DTT(LC、LCMSMS)
√ 甲醛(3207 比色法,LC)等
√ 蛋白降解(3121 分子排阻)、多聚体(IC、SEC、SALD)、化学修饰(LC、LCMSMS)等

√ 菌体蛋白(3412/3/4酶联免疫法)、C-多糖(3429 免疫化学法)、核酸、内毒素(1143 凝胶法和光度测定法)等残留
√ 化学试剂残留(3200 UV、GC、LC、AA、ICPMS、比色法等)
√ 游离载体蛋白和游离多糖等(IC)

√ 严格控制培养基成分(LCMSMS)
√ 控制失活病毒、细菌(MALDI-TOF)

√ 控制单个抗原成分的杂质
√ 生产引入杂质(UV、LC、GC、LCMS、GCMS等)
√ 抗原成分混合引起的特定杂质
3)变更事项对疫苗杂质控制的影响
应定期评估上市疫苗的生产工艺性能和杂质控制策略的有效性,持续优化产品杂质控制策略,如发生变更应参照相关要求开展变更前后的可比性研究等。
表 2为根据2025年版《中国药典》说明整理的人用疫苗杂质控制技术指导原则概括。
表2 人用疫苗杂质控制技术指导原则(9403)概括
| 目录 | 内容 | 细分细节 | 具体示例 | 涉及分析方法 |
|---|---|---|---|---|
| 疫苗杂质来源 | 工艺相关杂质 | 1、工艺过程中所用原材料 2、工艺过程所用原材料 3、直接接触药品的容器和包装系统 |
宿主细胞蛋白和核酸、培养基、化学试剂、辅料、包装材料浸/析出物等 | LC/LCMS/LCMSMS/ICPMS/EDX/EPMA/Q-TOF/TOC/TGA/GPC |
| 产品相关杂质 | - | 有效成分降解、聚合等 | IC/SEC/SALD/LC/LCMSMS | |
| 疫苗杂质控制的原则和策略 | 风险评估 | - | 根据产品特点、生产工艺、接种途径、目标人群等 | - |
| 全过程控制 | 1、生产用物料的控制 2、生产工艺控制 3、杂质检测方法的建立 4、杂质限度的设定原则 |
残留溶剂(0861)、包材相容性、方法验证(9101) | GC/GCMS/LC/LCMS/LCMSMS/ICPMS/EDX/EPMA/Q-TOF/TOC/TGA/GPC | |
| 全生命周期管理 | 定期评估 持续优化 变更需评估 |
- | - | |
| 不同类型疫苗杂质的控制要点 | - | 宿主细胞蛋白、培养基成分、核酸酶残留、化学试剂残留、有机溶剂残留等 | GC/GCMS/LC/LCMS/LCMSMS/MALDI-TOF /ICPMS/IC/SEC/SALD/UV | |
| 变更事项对疫苗杂质控制的影响 | 定期评估 持续优化 变更需评估 |
- | - | - |
2.增订各论双价人乳头瘤病毒疫苗(大肠埃希菌)检测要求
双价人乳头瘤病毒疫苗(大肠埃希菌)系由大肠埃希菌分别表达的重组人乳头瘤病毒(Human Papillomavirus,HPV)16型和18型的L1蛋白经纯化、组装成病毒样颗粒(Virus-like Particles,VLPs),并加入铝佐剂制成单价吸附原液,以适宜比例混合后分装制成。用于预防因16型、18型人乳头瘤病毒所致的持续感染以及相关疾病。
其单价原液检定(表 3)及成品检定(表 4)标准如下表。
注:以下内容根据2025年版《中国药典》说明整理。
表3 双价人乳头瘤病毒疫苗(大肠埃希菌)单价原液检定标准
| 序号 | 检测项目 | 检测方法 | 质量标准 |
|---|---|---|---|
| 1 | 鉴别试验 | 免疫化学法(通则3429标记免疫化学法一) | 供试品应为阳性 |
| 2 | 肽图 | 肽图检查法(通则3405第一法) | 供试品溶液色谱图形应与对照品溶液色谱图形一致 |
| 3 | 紫外光谱 | 通则0401 | 光路1cm、波长230~360nm下进行扫描,最大吸收峰波长应为278nm±3nm |
| 4 | N端氨基酸序列 | 氨基酸序列分析仪或其他批准的方法测定 | 氨基酸序列分析仪或其他批准的方法测定 |
| 5 | 分子量 | 电泳法(通则0541第五法) | 两型别L1蛋白分子量均应符合批准的要求 |
| 6 | pH值 | 通则0631 | 应符合批准的要求 |
| 7 | 蛋白质含量 | 蛋白质含量测定法(通则0731第四法)或其他批准方法测定蛋白质含量 | 应符合批准的要求 |
| 8 | 比活性 | 免疫化学法(通则3429标记免疫化学法一)进行试验,生物检定统计法(通则1431)中量反应平行线测定法或其他批准的方法计算供试品比活性 | 应符合批准的要求 |
| 9 | 纯度 | 电泳法(通则0541第五法) | 抗原纯度及完整L1蛋白单体含量应符合批准的要求 |
| 高效液相色谱法(通则0512) | 按面积归一化法计算病毒样颗粒纯度,均应不低于95.0% | ||
| 10 | 病毒样颗粒粒径 | 粒度和粒度分布测定法(通则0982第三法) | 应符合批准的要求 |
| 11 | 宿主菌体蛋白残留量 | 大肠埃希菌菌体蛋白质残留量测定法(通则3412),或采用经验证的方法进行试验 | 应符合批准的要求 |
| 12 | 宿主DNA残留量 | 外源性DNA残留量测定法(通则3407第二法)试验或其他批准方法 | 应符合批准的要求 |
| 13 | 二硫苏糖醇残留量 | 高效液相色谱法(通则0512) | 应符合批准的要求 |
| 14 | 聚山梨酯80 | 通则3203 | 应符合批准的要求 |
| 15 | 无菌检查 | 通则1101 | 应符合规定 |
| 16 | 细菌内毒素检查 | 通则1143凝胶限度法 | 40μg HPV16型蛋白中含细菌内毒素的量应小于5EU, 20μg HPV18型蛋白中含细菌内毒素的量应小于5EU |
表4 双价人乳头瘤病毒疫苗(大肠埃希菌)成品检定标准
| 序号 | 检测项目 | 检测方法 | 质量标准 |
|---|---|---|---|
| 1 | 鉴别试验 | 免疫化学法(通则3429标记免疫化学法一) | 供试品应为阳性 |
| 2 | 外观 | 直接观察法 | 乳白色混悬液体 |
| 3 | 装量 | 通则0102 | 应不低于标示量 |
| 4 | pH值 | 通则0631 | 应为6.0~7.4或符合批准的要求 |
| 5 | 铝含量 | 通则3106 | 应为0.35~0.49mg/ml或符合批准的要求 |
| 6 | 渗透压摩尔浓度 | 通则0632 | 应为486~594mOsmol/kg或符合批准的要求 |
| 7 | 聚山梨酯80 | 通则3203 | 应为60~120μg/ml或符合批准的要求 |
| 8 | 吸附完全性 | 免疫化学法(通则3429标记免疫化学法一) | 应不低于95% |
| 9 | 体外相对效力试验 | 免疫化学法(通则3429标记免疫化学法一),生物检定统计法(通则1431) | 体外相对效力均应不低于0.6 |
| 体内效力试验 | 假病毒中和法检测抗体,采用Reed-Muench公式计算供试品和效力标准品 | 体内效力均应不低于0.5 | |
| 10 | 无菌检查 | 通则1101 | 应符合规定 |
| 11 | 细菌内毒素检查 | 通则1143凝胶限度法 | 应小于10EU/剂 |
| 12 | 异常毒性检查 | 通则1141 | 应符合规定 |
3.人用疫苗杂质分析解决方案
疫苗中的杂质种类繁杂,来源多样,同时本指导原则强调了要重点关注分析方法的专属性和灵敏度,这使得杂质分析难度进一步提升。岛津于2017年起先后与权威机构和知名疫苗企业开展合作,有着非常丰富的经验和专业的团队,具有完整的疫苗杂质分析方案,助力广大用户应对新规发布及实施。
1)疫苗杂质分析/残留分析/纯度分析

超高效液相色谱仪
Nexera LC-40系列
• 智能、主控--可靠性强,远程监控及实验室一体化管理
• 倍速、高通--工作自动化,通量更大化
• 精巧、便捷--紧凑型和创造性结合,具备高灵敏、超低交叉污染
2)疫苗杂质分析/残留分析/纯度分析

三重四极杆质谱仪
LCMS-8060RX/8050RX/8045RX
• 出色的易用性--无需反复优化离子源参数,智能改善分析和工作流程
• 优秀的稳健性--兼具高灵敏度和稳健性,减少了由于污染引起的灵敏度下降
• 普适性参数设置--提升电离效率,提高低质量范围的灵敏度
3)疫苗蛋白分子量测定/序列分析/翻译后修饰分析

四极杆飞行时间液质联用仪
LCMS-9030/9050
• 可靠的质量准确度--追求日常使用便利性
• 超稳定快速谱图采集--长时间快速稳定检测,减少校正和维护
• 多功能扩展性--定性和定量兼备,媲美三重四极杆的高灵敏度
4)疫苗蛋白N端序列分析--Edman降解法

蛋白质测序仪
PPSQ-51A/53A
• 分析稳定性--基线稳定, 保留时间重现性好,高灵敏度检测
• 法规合规性--符合FDA 21 CFR Part 11要求的齐全功能
• 分析简便性--色谱图再处理,色谱图叠加,氨基酸序列自动推测
5)疫苗聚集体分析--激光衍射散射法

聚集体分析仪
Aggregates Sizer
• 宽泛粒径范围--定量评价亚可见粒子区域聚合体的浓度
• 高灵敏度--高分辨率、准确检测宽范围粒径分布
• 快速定量--实时监测聚合体的时间序列变化
4.疫苗杂质分析应用案例
1)液相色谱法检测疫苗中四种常见防腐剂残留
● 分析条件
分析仪器:岛津超高效液相色谱仪LC-40
色谱柱:Shimadzu Shim-pack GIST C18 100 mm x 2.1 mm I.D., 2.0 μm;
P/N: 227-30001-04; 岛津(上海)实验器材有限公司
流动相:A-水,B-乙腈
流速:0.4 mL/min
柱温:40 ℃
进样体积:5 μL
洗脱方式:梯度洗脱,B相初始浓度为10%。时间程序见表5。
表5 梯度洗脱时间程序
| Time | Module | Command | Value |
|---|---|---|---|
| 7.00 | Pumps | Pump B Conc. | 40 |
| 7.50 | Pumps | Pump B Conc. | 95 |
| 9.00 | Pumps | Pump B Conc. | 95 |
| 9.20 | Pumps | Pump B Conc. | 10 |
| 13.00 | Controller | Stop |
●属性及加标回收实验
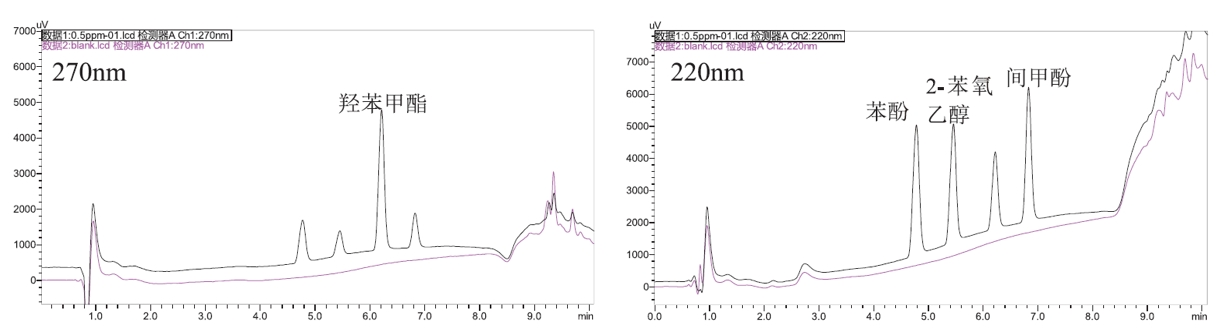
图1 对照品(0.5 ppm)和空白溶剂270nm和220nm色谱图
表6 样品加标回收率(n=3)
| 化合物名称 | 样品含量 ng/mL |
2 μg/mL | 20 μg/mL | ||
|---|---|---|---|---|---|
| 回收率/% | RSD/% | 回收率/% | RSD/% | ||
| 苯酚 | N.D. | 96.80 | 0.21 | 100.60 | 0.05 |
| 2-苯氧乙醇* | N.D. | 99.20 | 0.09 | 101.00 | 0.07 |
| 羟苯甲脂 | N.D. | 98.00 | 0.28 | 101.10 | 0.19 |
| 间甲酚 | N.D. | 98.10 | 0.17 | 101.30 | 0.10 |
注:N.D.表示未检出
结果显示,方法专属性良好(图 1),符合9403要求,且加标回收率在96.8~101.30%之间,RSD在0.05~0.28%之间(表 6),方法可靠,可为疫苗中防腐剂残留分析提供参考。
2)LCMSMS检测疫苗中卡那霉素残留
生物制品中卡那霉素的检测常用免疫法,但前处理复杂、灵敏度和专一性受限;LCMSMS方法前处理简单、专一性强、灵敏度高、分析速度快,因此本应用采用LCMSMS方法检测卡那霉素。
● 分析条件
分析仪器:岛津超高效液相色谱仪LC-40与三重四极杆质谱仪LCMS-8045联用系统
色谱柱:Shimadzu Shim-pack GIST Amide 150 mm x 2.1 mm I.D., 3.0 μm;
P/N: 227-30818-06; 岛津(上海)实验器材有限公司
流动相:A-250 mM甲酸铵+0.1% 甲酸水溶液,B-乙腈
流速:0.8 mL/min
柱温:50 ℃
进样体积:10 μL
洗脱方式:梯度洗脱,B相初始浓度为75%。时间程序见表7。
表7 梯度洗脱时间程序
| Time | Module | Command | Value |
|---|---|---|---|
| 2.00 | Pumps | Pump B Conc. | 5 |
| 3.00 | Pumps | Pump B Conc. | 5 |
| 3.10 | Pumps | Pump B Conc. | 75 |
| 5.00 | Controller | Stop |
● 专属性及加标回收实验
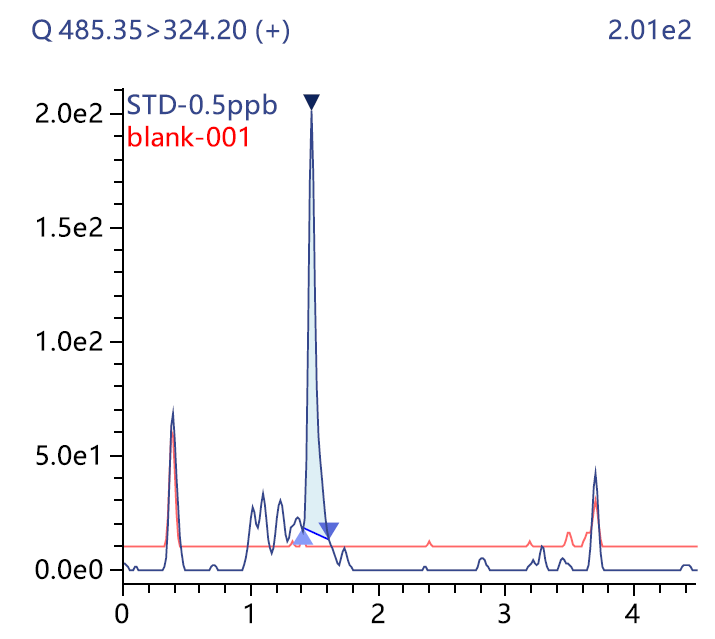
图2 对照品(0.5 ppm)和空白溶剂270nm和220nm色谱图
表8 样品加标回收率(n=3)
| 化合物名称 | 样品含量 ng/mL |
1.0 ng/mL | 10 ng/mL | 80 ng/mL | |||
|---|---|---|---|---|---|---|---|
| 回收率/% | RSD/% | 回收率/% | RSD/% | 回收率/% | RSD/% | ||
| 卡那霉素 | N.D. | 90.10 | 2.38 | 90.80 | 0.65 | 101.50 | 1.06 |
注:N.D.表示未检出
结果显示,方法专属性良好(图 2),符合9403要求,且加标回收率在90.10~101.50%之间,RSD在0.65~2.38%之间(表 8),方法可靠,可为疫苗中抗生素残留分析提供参考。
岛津应用资料:
1、液相色谱法检测疫苗中四种常见防腐剂残留
2、LCMSMS检测疫苗中卡那霉素残留
3、ICPE-9820同时测定百白破疫苗中的铝佐剂和硫柳汞
以上资料,可前往岛津中国官网https://www.shimadzu.com.cn/搜索获取。



